Pharmacological Group
Latin name
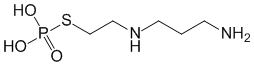
Amifostinum ( Amifostini).
Chemical name
S-[2-[(3-Аминопропил)амино]этил]дигидрофосфотиоат.
Used in the treatment
CAS Code
20537-88-6.
Pharmacological action
Цитопротективное.
Characteristics of the substance
Комплексообразующее средство.
Белый кристаллический порошок, легко растворим в воде. Молекулярная масса 214,22.
Белый кристаллический порошок, легко растворим в воде. Молекулярная масса 214,22.
Pharmacodynamics
Защищает клетки, не вовлеченные в опухолевый рост, от цитотоксического действия ДНК-связывающих противобластомных средств: алкилирующих (в тч цисплатина, циклофосфамида), некоторых синтетических (соединения платины) и антибиотиков (митомицин с). После в/в инфузии быстро дефосфорилируется при участии щелочной фосфатазы до свободного тиола (фармакологически активный метаболит) и затем - до неактивного дисульфидного метаболита. Способность амифостина по-разному действовать на опухолевые и нормальные клетки обусловлена более высокой активностью щелочной фосфатазы в клетках нормальных тканей по сравнению с клетками опухоли, что приводит к более быстрому образованию активного тиолового метаболита, а также к более высокой степени захвата. Уменьшает вероятность возникновения гемато-, нефро-, нейро- и ототоксических осложнений при использовании химиотерапевтических средств.
После 15-минутной инфузии в дозе 910 мг/м2 maxCmax составляет 200 мкмоль/л, активного метаболита - 35 мкмоль/л; период полураспределения (из плазмы) - менее 1 мин, Т1/2 (элиминации) - примерно 8 мин, объем распределения - 7 л, сl - 2 л/мин. Через 6 мин после введения в плазме остается менее 10% введенной дозы. Через 5-8 мин после инфузии активный метаболит определяется в клетках костного мозга. Выводится с мочой (в тч в виде метаболитов).
После 15-минутной инфузии в дозе 910 мг/м2 maxCmax составляет 200 мкмоль/л, активного метаболита - 35 мкмоль/л; период полураспределения (из плазмы) - менее 1 мин, Т1/2 (элиминации) - примерно 8 мин, объем распределения - 7 л, сl - 2 л/мин. Через 6 мин после введения в плазме остается менее 10% введенной дозы. Через 5-8 мин после инфузии активный метаболит определяется в клетках костного мозга. Выводится с мочой (в тч в виде метаболитов).
Indications for use
Профилактика гематотоксичности ДНК-связывающих химиотерапевтических средств. Профилактика нефро-, нейро- и ототоксичности препаратов платины.
Contraindications
Гиперчувствительность (в тч к соединениям аминотиола), артериальная гипотензия, дегидратация.
Restrictions on use
Аритмия, хроническая сердечная недостаточность, ИБС, инсульт, преходящие ишемические атаки (в тч в анамнезе), гипокальциемия, выраженные нарушения функции печени и/или почек, нефротический синдром, детский возраст (безопасность и эффективность не определены), возраст старше 70 лет.
Use during pregnancy and lactation
При беременности возможно, если польза для матери превышает потенциальный риск для плода (адекватных и строго контролируемых исследований у беременных женщин не проведено). Показана эмбриотоксичность амифостина у кроликов при введении в дозах 50 мг/кг (примерно 60% рекомендуемой дозы у человека в пересчете на площадь поверхности тела).
Категория действия на плод по FDA. с.
Необходимо прекратить грудное вскармливание (неизвестно, экскретируется ли амифостин или его метаболиты в грудное молоко женщин).
Категория действия на плод по FDA. с.
Необходимо прекратить грудное вскармливание (неизвестно, экскретируется ли амифостин или его метаболиты в грудное молоко женщин).
Side effects
Со стороны сердечно-сосудистой системы: преходящее снижение АД, реже - повышение дАД.
В рандомизированных исследованиях у пациентов с раком яичников введение амифостина в дозе 910 мг/м2 перед проведением химиотерапии вызывало транзиторное снижение АД у 62% пациентов. среднее время начала этого эффекта - 14 мин (при 15-минутной инфузии). средняя продолжительность - 6 мин. В основном значения АД возвращались к норме в течение 5-15 мин. Менее чем у 3% пациентов введение амифостина было прекращено ввиду чрезмерного снижения АД. В рандомизированных исследованиях у пациентов с раком головы и шеи при введении амифостина в дозе 200 мг/м2 перед радиотерапией, гипотензия отмечалась у 15% пациентов. У 17% введение амифостина было прекращено ввиду развития побочных эффектов.
Снижение АД в период введения амифостина не вызывало долгосрочных последствий со стороны ЦНС. сердечно-сосудистой системы и почек. но в клинических исследованиях не оценивалась безопасность амифостина у пожилых пациентов или у пациентов с предшествующими сердечно-сосудистыми или цереброваскулярными заболеваниями. Клинические проявления выраженной гипотензии обычно удается устранить путем инфузии жидкости и опусканием головного конца кровати больного. Гипотензия была ассоциирована с одним или несколькими из следующих побочных эффектов: апноэ. диспноэ. гипоксия. тахикардия. брадикардия. экстрасистолия. боль в груди. ишемия миокарда. судороги. В редких случаях на фоне снижения АД отмечались почечная недостаточность, инфаркт миокарда, прекращение дыхания и остановка сердца.
Редко - преходящее повышение АД (в тч и исходно повышенного), аритмии (фибрилляция или трепетание предсердий), наджелудочковая тахикардия. В некоторых случаях нарушения ритма сердца возникали на фоне аллергической реакции.
Со стороны органов ЖКТ. Тошнота и/или рвота.
В рандомизированных исследованиях у больных с раком яичников частота возникновения тяжелой тошноты/рвоты в первый день проведения химиотерапии циклофосфамидом/цисплатином составила: 10% - у пациентов. не получавших амифостин. и 19% - у пациентов на фоне амифостина. В рандомизированных исследованиях у пациентов с раком головы и шеи аналогичные показатели составляли 8 и 1%.
Со стороны кожных покровов. Серьезные. иногда фатальные. кожные реакции включали следующие: многоформная экссудативная эритема (в отдельных случаях - эксфолиативный дерматит. синдром Стивенса-Джонсона. токсический эпидермальный некролиз). Частота возникновения подобных тяжелых реакций составляет от 0,8 до 1,0 случаев на 10 тыс. пациентов при химиотерапии и от 6 до 9 случаев на 10 тыс. пациентов при лучевой терапии.
Аллергические реакции. Озноб с ощущением холода. дрожь. кожная сыпь. эозинофилия. диспноэ. снижение АД. кожные высыпания. крапивница. отек гортани. редко - развитие анафилактоидных реакций и остановка сердца.
Прочие. Покраснение лица. сопровождающееся ощущением тепла. озноб. головокружение. сонливость. икота. чиханье. судороги. снижение концентрации кальция в сыворотке крови. клинически выраженная гипокальциемия (1%).
В рандомизированных исследованиях у пациентов с раком яичников введение амифостина в дозе 910 мг/м2 перед проведением химиотерапии вызывало транзиторное снижение АД у 62% пациентов. среднее время начала этого эффекта - 14 мин (при 15-минутной инфузии). средняя продолжительность - 6 мин. В основном значения АД возвращались к норме в течение 5-15 мин. Менее чем у 3% пациентов введение амифостина было прекращено ввиду чрезмерного снижения АД. В рандомизированных исследованиях у пациентов с раком головы и шеи при введении амифостина в дозе 200 мг/м2 перед радиотерапией, гипотензия отмечалась у 15% пациентов. У 17% введение амифостина было прекращено ввиду развития побочных эффектов.
Снижение АД в период введения амифостина не вызывало долгосрочных последствий со стороны ЦНС. сердечно-сосудистой системы и почек. но в клинических исследованиях не оценивалась безопасность амифостина у пожилых пациентов или у пациентов с предшествующими сердечно-сосудистыми или цереброваскулярными заболеваниями. Клинические проявления выраженной гипотензии обычно удается устранить путем инфузии жидкости и опусканием головного конца кровати больного. Гипотензия была ассоциирована с одним или несколькими из следующих побочных эффектов: апноэ. диспноэ. гипоксия. тахикардия. брадикардия. экстрасистолия. боль в груди. ишемия миокарда. судороги. В редких случаях на фоне снижения АД отмечались почечная недостаточность, инфаркт миокарда, прекращение дыхания и остановка сердца.
Редко - преходящее повышение АД (в тч и исходно повышенного), аритмии (фибрилляция или трепетание предсердий), наджелудочковая тахикардия. В некоторых случаях нарушения ритма сердца возникали на фоне аллергической реакции.
Со стороны органов ЖКТ. Тошнота и/или рвота.
В рандомизированных исследованиях у больных с раком яичников частота возникновения тяжелой тошноты/рвоты в первый день проведения химиотерапии циклофосфамидом/цисплатином составила: 10% - у пациентов. не получавших амифостин. и 19% - у пациентов на фоне амифостина. В рандомизированных исследованиях у пациентов с раком головы и шеи аналогичные показатели составляли 8 и 1%.
Со стороны кожных покровов. Серьезные. иногда фатальные. кожные реакции включали следующие: многоформная экссудативная эритема (в отдельных случаях - эксфолиативный дерматит. синдром Стивенса-Джонсона. токсический эпидермальный некролиз). Частота возникновения подобных тяжелых реакций составляет от 0,8 до 1,0 случаев на 10 тыс. пациентов при химиотерапии и от 6 до 9 случаев на 10 тыс. пациентов при лучевой терапии.
Аллергические реакции. Озноб с ощущением холода. дрожь. кожная сыпь. эозинофилия. диспноэ. снижение АД. кожные высыпания. крапивница. отек гортани. редко - развитие анафилактоидных реакций и остановка сердца.
Прочие. Покраснение лица. сопровождающееся ощущением тепла. озноб. головокружение. сонливость. икота. чиханье. судороги. снижение концентрации кальция в сыворотке крови. клинически выраженная гипокальциемия (1%).
Interaction
За счет быстрого выведения из плазмы риск взаимодействия с другими ЛС невелик. При совместном применении амифостина с гипотензивными препаратами или другими ЛС, снижающими АД, возможно усиление гипотензивного эффекта.
Overdose
Симптомы. Выраженное снижение АД, коллапс, потеря сознания.
Лечение. Симптоматическое - больному придают положение Тренделенбурга, вводят в/в изотонический солевой раствор.
Лечение. Симптоматическое - больному придают положение Тренделенбурга, вводят в/в изотонический солевой раствор.
Method of drug use and dosage
В/в инфузионно - 1 раз в сутки в течение 15 мин, за 30 мин до введения химиотерапевтического средства; рекомендуемая начальная доза у взрослых - 910 мг/м2. Перед введением 0,5 г лиофилизированного порошка (содержимое 1 флакона) разводят в 9,5 мл стерильного 0,9% раствора натрия хлорида. Инфузию проводят под контролем АД (желателен мониторинг). При снижении исходных значений сАД со 100 на 20 мм , со 100-119 на 25 мм , со 120-139 на 30 мм , со 140-179 на 40 мм или со 180 на 50 мм , введение прерывают на 5 мин. Если за этот период показатели сАД возвращаются к исходным и состояние больного не ухудшается, инфузию возобновляют в прежней дозе. Если полная доза не может быть введена, ее снижают до 740 мг/м2.
Application precautions
Во время введения больному необходимо находиться в положении лежа на спине. Инфузию прекращают при значительном снижении АД. При использовании на фоне химиопрепаратов, вызывающих рвоту, рекомендуется прием противорвотных средств (непосредственно до или во время инфузии) и контроль за балансом жидкости во время лечения. При риске развития гипокальциемии, в тч в случае нефротического синдрома, необходимо наблюдать за уровнем кальция в сыворотке крови (предпочтителен мониторинг).
Сопутствующую гипотензивную терапию отменяют за 24 ч до предполагаемого введения препарата.
Сопутствующую гипотензивную терапию отменяют за 24 ч до предполагаемого введения препарата.
Included in the composition
- — Ethyol