ICD-10 codes
Introduction
МКБ 10: I46 / I46.0 / I46.1 / I46.9 / I47.2 / I49.0 / I49.3.
Год утверждения (частота пересмотра): 2016 (7-10 лет).
ID: КР386.
Профессиональные ассоциации.
• Обществом специалистов по неотложной кардиологии.
Год утверждения (частота пересмотра): 2016 (7-10 лет).
ID: КР386.
Профессиональные ассоциации.
• Обществом специалистов по неотложной кардиологии.
Professional associations
• Обществом специалистов по неотложной кардиологии.
 List of abbreviations
List of abbreviations
TdP - полиморфная желудочковая тахикардия типа «пируэт» (torsade de pointes).
АВ - атриовентрикулярный.
АДПЖ - аритмогенная дисплазия-кардиомиопатия правого желудочка.
ВСС - внезапная сердечная смерть.
ЖТ - желудочковая тахикардия.
ЖЭ - желудочковая экстрасистолия.
ИБС - ишемическая болезнь сердца.
ИКД - имлпантируемый кардиовертер-дефибриллятор.
КТ - компьютерная томография.
ЛЖ - левый желудочек.
МРТ - магнитно-резонансная томография.
НПЖТ - непрерывно рецидивирующая желудочковая тахикрадия.
ПЖ - правый желудочек.
РЧА - радиочастотная аблация.
СУИQT - синдром удлиненного интервала QT.
ТЖ - трепетание желудочков.
ФВ - фракция выброса.
ФЖ - фибрилляция желудочков.
ХМ ЭКГ - Холтеровское мониторирование ЭКГ.
ЭФИ - электрофизиологическое исследование.
ЭХО КГ - Эхокардиография.
АВ - атриовентрикулярный.
АДПЖ - аритмогенная дисплазия-кардиомиопатия правого желудочка.
ВСС - внезапная сердечная смерть.
ЖТ - желудочковая тахикардия.
ЖЭ - желудочковая экстрасистолия.
ИБС - ишемическая болезнь сердца.
ИКД - имлпантируемый кардиовертер-дефибриллятор.
КТ - компьютерная томография.
ЛЖ - левый желудочек.
МРТ - магнитно-резонансная томография.
НПЖТ - непрерывно рецидивирующая желудочковая тахикрадия.
ПЖ - правый желудочек.
РЧА - радиочастотная аблация.
СУИQT - синдром удлиненного интервала QT.
ТЖ - трепетание желудочков.
ФВ - фракция выброса.
ФЖ - фибрилляция желудочков.
ХМ ЭКГ - Холтеровское мониторирование ЭКГ.
ЭФИ - электрофизиологическое исследование.
ЭХО КГ - Эхокардиография.
Terms and definitions
Желудочковая экстраситолия. Преждевременная (по отношению к основному ритму) электрическая активация сердца, индуцированная импульсом, источник которого находится в ножках или разветвлениях пучка Гиса, в волокнах Пуркинье или рабочем миокарде желудочков.
Желудочковая тахикардия. Ускоренный ритм (как минимум 3 комплекса QRS c частотой сердечных сокращений более 100 уд./мин.), источник которого находится в ножках или разветвлениях пучка Гиса, в волокнах Пуркинье или рабочем миокарде желудочков. Устойчивой считается тахикардия, при которой длительность пароксизма равна или превышает 30 сек., а неустойчивой - менее 30 сек.
Реципрокная желудочковая тахикардия. Пароксизмальная желудочковая тахикардия, обусловленная механизмом повторного входа волны возбуждения (re-entry). Данная форма тахикардии индуцируется желудочковой экстрасистолией (или желудочковыми экстрастимулами в ходе внутрисердечного электрофизиологического исследования) и может быть купирована с помощью стимуляции желудочков.
Аритмогенная дисплазия-кардиомиопатия правого желудочка. Генетически детерминированное заболевание сердца, которому характерно замещение миокарда преимущественно правого желудочка (ПЖ) жировой и соединительной тканями.
Катехоламинергическая полиморфная ЖТ (Catecholaminergic polymorphic ventricular tachycardia; сPVT) - наследственное заболевание, проявляющееся пароксизмами полиморфной или двунаправленной ЖТ, возникающими на фоне физической нагрузки или эмоционального стресса, нередко протекающими с потерей сознания.
Фасцикулярная левожелудочковая тахикардия. Редкая форма пароксизмальной мономорфной ЖТ, в основе которой лежит механизм re-entry с участием в цепи циркуляции волны возбуждения задне-нижнего разветвления левой ножки пучка Гиса.
Непрерывно рецидивирующая (непароксизмальная) ЖТ. Редкая форма мономорфной ЖТ, обусловленная патологическим автоматизмом или триггерной активностью (источник тахикардии, как правило, находится в выносящем тракте правого желудочка, в зоне, расположенной непосредственно под клапаном легочной артерии; другое её название - ЖТ из выносящего тракта правого желудочка).
Внезапная смерть. Это смерть, от которой первые симптомы ухудшения состояния пациента отделены сроком, не более 1 часа, а в реальной практике этот период нередко измеряется минутами.
Первичная профилактика внезапной смерти. Мероприятия, направленные на снижение риска ВСС у лиц, имеющих повышенный риск ВСС, но без анамнеза угрожающих жизни аритмий или предотвращенной остановки сердца.
Вторичная профилактика внезапной смерти. Мероприятия, направленные на снижение риска ВСС у лиц, имеющих анамнез угрожающих жизни аритмий или предотвращенной остановки сердца.
Синдром Андерсена-Тавила. Редкая форма заболевания, при которой удлинение интервала QT сопровождается появлением волны U, пароксизмами как полиморфной желудочковой тахикардии типа TdP, так и двунаправленной желудочковой тахикардии.
Желудочковая тахикардия. Ускоренный ритм (как минимум 3 комплекса QRS c частотой сердечных сокращений более 100 уд./мин.), источник которого находится в ножках или разветвлениях пучка Гиса, в волокнах Пуркинье или рабочем миокарде желудочков. Устойчивой считается тахикардия, при которой длительность пароксизма равна или превышает 30 сек., а неустойчивой - менее 30 сек.
Реципрокная желудочковая тахикардия. Пароксизмальная желудочковая тахикардия, обусловленная механизмом повторного входа волны возбуждения (re-entry). Данная форма тахикардии индуцируется желудочковой экстрасистолией (или желудочковыми экстрастимулами в ходе внутрисердечного электрофизиологического исследования) и может быть купирована с помощью стимуляции желудочков.
Аритмогенная дисплазия-кардиомиопатия правого желудочка. Генетически детерминированное заболевание сердца, которому характерно замещение миокарда преимущественно правого желудочка (ПЖ) жировой и соединительной тканями.
Катехоламинергическая полиморфная ЖТ (Catecholaminergic polymorphic ventricular tachycardia; сPVT) - наследственное заболевание, проявляющееся пароксизмами полиморфной или двунаправленной ЖТ, возникающими на фоне физической нагрузки или эмоционального стресса, нередко протекающими с потерей сознания.
Фасцикулярная левожелудочковая тахикардия. Редкая форма пароксизмальной мономорфной ЖТ, в основе которой лежит механизм re-entry с участием в цепи циркуляции волны возбуждения задне-нижнего разветвления левой ножки пучка Гиса.
Непрерывно рецидивирующая (непароксизмальная) ЖТ. Редкая форма мономорфной ЖТ, обусловленная патологическим автоматизмом или триггерной активностью (источник тахикардии, как правило, находится в выносящем тракте правого желудочка, в зоне, расположенной непосредственно под клапаном легочной артерии; другое её название - ЖТ из выносящего тракта правого желудочка).
Внезапная смерть. Это смерть, от которой первые симптомы ухудшения состояния пациента отделены сроком, не более 1 часа, а в реальной практике этот период нередко измеряется минутами.
Первичная профилактика внезапной смерти. Мероприятия, направленные на снижение риска ВСС у лиц, имеющих повышенный риск ВСС, но без анамнеза угрожающих жизни аритмий или предотвращенной остановки сердца.
Вторичная профилактика внезапной смерти. Мероприятия, направленные на снижение риска ВСС у лиц, имеющих анамнез угрожающих жизни аритмий или предотвращенной остановки сердца.
Синдром Андерсена-Тавила. Редкая форма заболевания, при которой удлинение интервала QT сопровождается появлением волны U, пароксизмами как полиморфной желудочковой тахикардии типа TdP, так и двунаправленной желудочковой тахикардии.
Description
1,1 Определения.
Желудочковая экстрасистола. Преждевременная (по отношению к основному ритму) электрическая активация сердца, индуцированная импульсом, источник которого находится в ножках или разветвлениях пучка Гиса, в волокнах Пуркинье или рабочем миокарде желудочков ( 1).1. Одиночная желудочковая экстрасистола (обозначена стрелкой). ПКП - полная компенсаторная пауза. 2RR - два нормальных сердечных цикла. Холтеровская мониторная запись ЭКГ).
Термином «желудочковая парасистолия» обозначают такое состояние, при котором сердечным ритмом управляют два независимых водителя. Один из них основной (наиболее часто - синусовый узел), другой - парасистолический, расположен в желудочках [1-3].
Пароксизмальная мономорфная желудочковая тахикардия (ЖТ) - такая форма ЖТ, при которой морфология комплекса QRS на ЭКГ в течение пароксизма не изменяется ( 2).
2. Спонтанное развитие пароксизма мономорфной желудочковой тахикардии (Холтеровская мониторная запись ЭКГ). Стрелкой обозначено сливное сокращение.
Мономорфная ЖТ протекает в виде пароксизмов с частотой сердечных сокращений от 100 (чаще от 150) до 250 ударов в минуту. По своим клиническим проявлениям, это одна из наиболее тяжелых форм нарушений ритма сердца. Высокая частота ритма во время пароксизма, особенно на фоне тяжелого органического поражения мышцы сердца, нередко приводит к стремительному развитию острой левожелудочковой недостаточности, коллапсу, аритмическому шоку, обмороку, клинической картине остановки кровообращения, что иногда определяется термином «ЖТ без пульса». ЖТ характеризуется высоким риском трансформации в фибрилляцию желудочков (ФЖ), являющуюся непосредственным механизмом внезапной сердечной смерти (ВСС). Этим определяется ее крайне неблагоприятное значение для прогноза жизни [3-6].
Фасцикулярная левожелудочковая тахикардия - редкая форма пароксизмальной мономорфной ЖТ, в основе которой лежит механизм re-entry с участием в цепи циркуляции волны возбуждения задне-нижнего разветвления левой ножки пучка Гиса. Обычно выявляется у молодых лиц, не имеющих признаков органического заболевания сердца, не имеет тяжёлых клинических проявлений, не трансформируется в ФЖ. Прогноз благоприятен [7-11]. Комплексы QRS во время пароксизма имеют конфигурацию, характерную для блокады правой ножки пучка Гиса с отклонением электрической оси сердца влево ( 3).
3. Фасцикулярная левожелудочковая тахикардия. Стрелкой обозначен синусовый «захват».
Непрерывно рецидивирующая (непароксизмальная) ЖТ - редкая форма мономорфной ЖТ, обусловленная патологическим автоматизмом или триггерной активностью (источник тахикардии, как правило, находится в выносящем тракте правого желудочка, в зоне, расположенной непосредственно под клапаном легочной артерии; другое её название - ЖТ из выносящего тракта правого желудочка). Характерно преобладание зубцов R в левых грудных отведениях и зубцов S - в правых ( 4). Непароксизмальная желудочковая тахикардия обычно не имеет явных клинических проявлений, часто выявляется случайно при аускультации сердца во время врачебного осмотра, или при записи ЭКГ. Характерно ее возникновение у детей, лиц молодого возраста, не имеющих признаков органического поражения сердца. Прогноз для жизни больных благоприятен.
4. Непрерывно рецидивирующая тахикардия из выносящего тракта правого желудочка (непрерывная запись). Цифрами обозначены интервалы между желудочковыми комплексами в миллисекундах. Стрелкой обозначено сливное сокращение.
Полиморфная ЖТ характеризуется прогрессирующими (от удара к удару) изменениями комплексов QRS по конфигурации, амплитуде и направлению преобладающих электрических отклонений. Чаще всего встречается полиморфная желудочковая тахикардия типа пируэт (Torsade de Pointes - TdP; другое название «двунаправленная-веретенообразная» ЖТ; 5), возникающая при патологическом удлинении интервала QT. Одна из самых опасных форм ЖТ в виду тяжёлых клинических проявлений (гемодинамическая нестабильность) и высокого риска трансформации в ФЖ.
5. Развитие пароксизма полиморфной желудочковой тахикардии типа Torsade de Pointes на фоне физической нагрузки у больного синдрома Романо-Уорда (фрагмент непрерывной записи суточного мониторирования ЭКГ по Холтеру).
В основе трепетания желудочков (ТЖ), так же, как и мономорфной ЖТ, лежит механизм повторного входа волны возбуждения, при котором длительность цикла re-entry существенно короче, частота ритма составляет 250 и более в 1 мин ( 6А).
ФЖ представляет собой частые, абсолютно некоординированные сокращения мышечных волокон. Механизмом ФЖ является re-entry, при котором фронты возбуждения изменяют пути своего движения от цикла к циклу. На ЭКГ регистрируется нерегулярная, хаотическая электрическая активность в виде полиморфных осцилляций, постоянно изменяющихся по своей конфигурации, амплитуде, продолжительности и частоте, диапазон которой составляет от 300 и выше в 1 мин ( 6В).
6. Спонтанное развитие трепетания желудочков (А) с эволюцией в синусоидальную кривую (Б) и последующим переходом в фибрилляцию желудочков (В). Холтеровская мониторная запись ЭКГ, зафиксировавшая момент внезапной аритмической смерти.
Reasons
Механизмы повторного входа волны возбуждения (re-entry; наиболее часто) или триггерная активность, инициируемая ранними или поздними постдеполяризациями, в подавляющем большинстве случаев лежат в основе желудочковой экстрасистолии (ЖЭ).
У пациентов, не имеющих структурного заболевания сердца, может отмечаться идиопатическая ЖЭ (прогноз благоприятен, лечение требуется только при плохой субъективной переносимости ЖЭ или в случае развития вторичной кардиомиопатии на фоне частой ЖЭ). Основными причинами возникновения ЖЭ являются хроническая ИБС, постинфарктный кардиосклероз, гипертрофия миокарда (обусловленная гипертрофической кардиомиопатией, артериальной гипертонией, пороками аортального клапана ), воспалительные заболевания миокарда, кардиомиопатии (дилатационная, гипертрофическая, аритмогенная дисплазия миокарда правого желудочка ), инфильтративные заболевания миокарда. ЖЭ может быть следствием гликозидной интоксикации, применения антиаритмических препаратов (прежде всего I класса, реже - III класса), нарушений электролитного баланса (гипокалемия, гипомагнемия).
При желудочковой парасистолии так называемый парасистолический очаг защищен «блоком входа» от проникновения в него электрических импульсов, генерируемых с более высокой частотой в основном водителе ритма, что является первым обязательным условием проявления парасистолии. Эта защита предотвращает «разрядку» парасистолического очага и обеспечивает для него возможность генерирования импульсов с собственной периодичностью. Блок входа всегда однонаправленный и не препятствует выходу электрических импульсов из парасистолического фокуса.
В абсолютном большинстве случаев в основе пароксизмальной мономорфной ЖТ лежит механизм re-entry. Формирование условий для возникновения феномена re-entry в миокарде желудочков, в виде зон замедленного проведения возбуждения, участков мышцы сердца, неоднородных по величине рефрактерных периодов, обычно связано со значительными патологическими изменениями в миокарде. Вот почему пароксизмальная ЖТ в подавляющем большинстве случаев осложняет течение тяжелых заболеваний сердца, таких как ИБС, особенно при наличии постинфарктных рубцов и хронической аневризмы левого желудочка, воспалительных заболеваний миокарда, кардиомиопатий (дилатационная, гипертрофическая, аритмогенная дисплазия-кардиомиопатия правого желудочка ), инфильтративных заболевания миокарда.
Тахикардия типа TdP является главным, специфичным и очень опасным клиническим проявлением синдромов удлиненного интервала QT. Известны врожденные, генетически обусловленные варианты удлинения интервала QT. Приобретенные формы синдрома удлиненного интервала QT могут быть обусловлены целым рядом факторов, приводящих к замедлению процессов реполяризации миокарда желудочков. Поскольку интервал QT является частотно-зависимым показателем, тяжёлая брадикардия, связанная с дисфункцией синусового узла, либо с предсердно-желудочковой блокадой, может приводить к патологическому удлинению интервала QT с развитием TdP ( 7). Удлинение интервала QT может быть электрокардиографическим проявлением нарушений электролитного обмена (гипокалиемия, гипомагниемия) вследствие применения диуретиков или патологии надпочечников (синдром Конна), нарушения белкового питания (длительное «диетическое» голодание, неврогенная анорексия, длительное парентеральное питание ), интоксикации фосфорорганическими соединениями, гипотиреоза. Наконец, приобретенный синдром удлиненного интервала QT является одним из возможных нежелательных эффектов лекарств (антиаритмических препаратов IА и III классов, психотропных средств фенотиазинового ряда, трициклических антидепрессантов, эритромицина, фторхинолонов, противоаллергических препаратов и многих других средств). Постоянно обновляемый перечень препаратов, удлиняющих интервал QT, представлен на сайте http://www.azcert.org.
7. Рецидивирующие эпизоды желудочковой тахикардии типа torsade de pointes на фоне предсердно-желудочковой блокады III степени. Синусовая тахикардия предсердий (зубцы Р с частотой 95-105 в мин.) диссоциирует с ритмом желудочков с частотой 28-35 в мин. Значения интервала QT составляют 550-620 мс.
При отсутствии патологического удлинения интервала QT, полиморфная ЖТ наиболее часто бывает следствием острой ишемии миокарда, прежде всего острого инфаркта миокарда, а также других форм острого повреждения миокарда.
В настоящее время выделяют две основные причины врождённых желудочковых нарушений ритма сердца - так называемую «первичную электрическую болезнь сердца» («primary electric heart disease»), которую обнаруживают у лиц, не имеющих признаков органической патологии сердечно-сосудистой системы, и врождённые структурные заболевания сердца.
Основной причиной генетически детерминированных желудочковых аритмий при «первичной электрической болезни сердца» является дисфункция ионных каналов и насосов, играющих важнейшую роль в процессах деполяризации и реполяризации. В англоязычной литературе данные состояния обозначают также термином «каналопатии» («channelopathies»). К ним относят синдром удлиненного интервала QT, синдром Бругада, синдром укороченного интервала QT и катехоламинергическую полиморфную желудочковую тахикардию. Общими клиническими проявлениями данных заболеваний являются приступы потери сознания, обусловленные рецидивами желудочковой тахикардии (ЖТ), чаще TdP, случаи внезапной сердечной смерти (ВСС) при отсутствии признаков структурного заболевания сердца и наследственный характер заболевания [11-12].
Наследственный синдром удлинённого интервала QT (СУИQT, в англоязычной литературе - Long QT syndrome - LQTS или LQT) является наиболее частым и наиболее изученным из данных заболеваний, проявляющимся удлинением интервала QT на ЭКГ [при отсутствии других вызывающих это изменение причин], рецидивирующими синкопальными и пресинкопальными состояниями вследствие пароксизмов TdP, а также случаями ВСС [13-16].
Описаны следующие фенотипические формы СУИQT: синдром Романо-Уорда (Romano-Ward), синдром Джервелла и Ланге-Нильсена (Jervell and Lange-Nielsen), синдром Андерсена-Тавила (Andresen-Tawil) и синдром Тимоти (Timothy).
Наиболее распространённая форма заболевания с аутосомно-доминантным типом наследования - синдром Романо-Уорда, характерными клиническими проявлениями которого являются увеличение продолжительности интервала QT, рецидивирующие синкопальные состояния, чаще всего обусловленные полиморфной желудочковой тахикардией (ЖТ) типа пируэт, и наследственный характер заболевания. Более 90% случаев синдрома Романо-Уорда представлены СУИQT 1-го (СУИQT1), 2-го (СУИQT2) и 3-го (СУИQT3) типов, имеющих особенности клинических и электрокардиографических проявлений (табл. 1, 8).
Таблица 1. Клиническая характеристика основных типов наследственного синдрома удлинённого интервала QT.
8. Изменения ЭКГ при различных типах наследственного синдрома удлиненного интервала QT: (А) - широкая гладкая волна T при СУИQT1; (Б) - двухфазная T-волна при СУИQT2; (В) - низкоамплитудная и укороченная T-волна с удлиненным, горизонтальным ST-сегментом при СУИQT3.
Существенно реже встречается аутосомно-рецессивная форма заболевания (синдром Джервелла и Ланге-Нильсена; мутации в генах KCNQ1 и KCNE1), для которой характерны врождённая нейросенсорная тугоухость, более выраженное увеличение длительности интервала QT и большая частота опасных для жизни желудочковых аритмий.
Синдром Андерсена-Тавила - редкая форма заболевания, при которой удлинение интервала QT сопровождается появлением волны U, пароксизмами как полиморфной желудочковой тахикардии типа TdP, так и двунаправленной желудочковой тахикардии. Обычно заболевание обусловлено мутацией в гене KCNJ2, кодирующем α-субъединицу калиевых каналов Kir2,1, генерирующих ток IK1. Характерные экстракардиальные проявления заболевания, такие как аномалии развития костной системы (низкорослость, микрогнатия, большое расстояние между глазницами, низкое расположение ушных раковин, сколиоз, клинодактилиия), гипокалемия и периодический калий-зависимый паралич, присутствуют не у всех больных. Синдром Андерсена-Тавила - заболевание с аутосомно-доминантным типом наследования, однако семейный характер заболевания прослеживается далеко не всегда, в связи с трудностями диагностики, неспецифическими клиническими проявлениями заболевания и неполной пенетрантностью мутантных генов. До 50% случаев заболевания обусловлены мутацией de novo.
Синдром Тимоти - крайне редкая форма СУИQT, обусловленная мутацией в гене сACNA1c, кодирующем α-субъединицу кальциевых каналов сaV1,2. При данном синдроме отмечают наиболее выраженное удлинение интервалов QT и QTc (до 700 мс), сопровождающееся крайне высоким риском ВСС (средняя продолжительность жизни составляет 2,5 года). До 60% больных имеет различные врождённые пороки сердца и различные нарушения проводимости. Среди экстракардиальных проявлений заболевания описаны когнитивные нарушения, гипогликемия, иммунодефициты, аномалии строения лица, частичное или полное сращение пальцев кистей и стоп (синдактилия). Синдром Тимоти наследуется по аутосомно-доминантному типу, однако подавляющее большинство случаев заболевания обусловлено мутацией de novo [16].
Синдром Бругада, характеризующийся ЭКГ признаками блокады правой ножки пучка Гиса с элевацией точки J и сегмента ST в правых прекордиальных отведениях и проявляющийся клинически рецидивирующими синкопальными состояниями, а также случаями ВСС, которая наступает чаще у лиц мужского пола в возрасте 30-40 лет, назван в честь исследователей, описавших взаимосвязь этих проявлений в 1992 г. Заболевание наследуется по аутосомно-доминантному типу, при этом характерна неполная пенетрантность генетических изменений. Синдром Бругада вызывают мутации в гене α-субъединицы натриевых каналов SCN5A, приводящие к уменьшению силы входящего натриевого тока (INa) [18-22].
Желудочковые тахикардии, (преимущественно полиморфная, крайне редко - мономорфная) характеризующиеся высоким риском трансформации в фибрилляцию желудочков, являются основным клиническим проявлением синдрома Бругада. Характерно их возникновение в покое, во время ночного сна, что делает более вероятным их выявление с помощью ХМ ЭКГ, а не при стандартной записи ЭКГ ( 9). Одним из клинических проявлений, сопровождающих эти аритмические события, могут быть эпизоды хриплого (агонального) дыхания во сне. Желудочковые тахикардии могут провоцироваться лихорадочными состояниями, а также рядом лекарственных препаратов (перечень представлен на сайте http://brugadadrugs.org). Симптомы заболевания проявляются обычно у взрослых, а средний возраст ВСС составляет 41±15 лет. При синдроме Бругада чаще чем в общей популяции регистрируют случаи суправентрикулярных тахиаритмий [23-24].
9. Неустойчивый пароксизм (выделен рамкой) полиморфной желудочковой тахикардии (частота сердечных сокращений 160-180 уд./мин. Холтеровская мониторная запись ЭКГ в 12 отведениях у больного синдрома Бругада. Время возникновения пароксизма - 23 часа. Стрелками в отведении V1 указана элевация точки J в сокращениях синусового ритма.
Катехоламинергическая полиморфная ЖТ (Catecholaminergic polymorphic ventricular tachycardia; сPVT) - наследственное заболевание, проявляющееся пароксизмами полиморфной или двунаправленной ЖТ, возникающими на фоне физической нагрузки или эмоционального стресса ( 10), нередко протекающими с потерей сознания. Заболевание обусловлено нарушениями внутриклеточного обмена ионов сa2+ вследствие мутаций генов RyR2 (наследуется аутосомно-доминантно) и сASQ2 (наследуется аутосомно-рецессивно). Характеризуется злокачественным течением и высоким риском ВСС при отсутствии адекватного лечения [25-26].
10. Эпизоды катехоламин-зависимой полиморфной желудочковой тахикардии из 16 комплексов (А), 10 комплексов (Б), 11 комплексов (С), с частотой 260-307 уд./мин, зарегистрированные при суточном мониторировании ЭКГ по Холтеру во время эмоционального стресса (напряженный разговор по телефону) у больного 36 лет.
Синдром укороченного интервала QT (Short QT Syndrome; ShortQTS) является редким заболеванием, при котором на ЭКГ регистрируют уменьшение продолжительности интервалов QT/QTc и высокий симметричный зубец T в правых прекордиальных отведениях ( 11). Основными клиническими проявлениями заболевания являются синкопальные состояния, обусловленные пароксизмами ЖТ, что сопровождается повышенным риском ВСС. Наследование осуществляется по аутосомно-доминантному типу. Заболевание вызывают мутации в генах калиевых каналов (KCNH2, KCNQ1, KCNJ2), приводящие к усилению генерируемых ими токов К+, укорочению длительности фазы реполяризации потенциала действия и уменьшению продолжительности рефрактерных периодов возбудимых тканей сердца, что предрасполагает возникновению аритмий по механизму re-entry [27-28].
11. ЭКГ пациента с синдромом укороченного интервала QT. Высокоамплитудные симметричные зубцы T в V2-V4. QT = 220 мс.
Существует целый ряд наследственных структурных заболеваний сердца, проявляющихся тяжелыми желудочковыми тахиаритмиями и случаями ВСС, наличие которых может быть ведущим клиническим симптомом заболевания, определяющим прогноз жизни пациента.Наиболее распространёнными из них являются гипертрофическая и дилатационная кардиомиопатии, а также аритмогенная дисплазия-кардиомиопатия правого желудочка (АДПЖ).
АДПЖ - генетически детерминированное заболевание сердца, которому характерно замещение миокарда преимущественно правого желудочка (ПЖ) жировой и соединительной тканями. Клинически заболевание проявляется нарушениями ритма сердца - ЖЭ и ЖТ, сопровождающимися высоким риском ВСС у лиц молодого возраста (АДПЖ является одной из ведущих причин ВСС в возрасте до 30 лет), а также прогрессирующей сердечной недостаточностью [29-31].
АДПЖ - прогрессирующее заболевание, в клиническом течении которого выделяют следующие стадии:
• Начальная субклиническая стадия, во время которой проявления заболевания отсутствуют.
• Стадия «электрических» проявлений, во время которой имеющиеся у пациентов структурные поражения ещё не приводят к снижению систолической функции миокарда, но могут способствовать возникновению нарушений ритма сердца и ВСС [32-34].
• Стадия правожелудочковой недостаточности развивается по мере прогрессирования заболевания, при большем объёме зоны поражения миокарда правого желудочка [35-37].
• Терминальная стадия, проявляющаяся бивентрикулярной недостаточностью, симптомы которой могут быть полностью аналогичны дилатационной кардиомиопатии [38-40].
Клинические проявления АДПЖ могут быть обусловлены как нарушениями ритма сердца, так и прогрессирующей сердечной недостаточностью. Выделяют следующие варианты клинического течения АДПЖ:
• скрытый, при котором ВСС может быть единственным проявлением заболевания;
• аритмический, которому характерны ЖЭ и ЖТ, исходящие из правого желудочка, с морфологией комплексов QRS по типу блокады левой ножки пучка Гиса (БЛНПГ);
• проявляющийся сердечной недостаточностью, преимущественно правожелудочковой, с наличием или отсутствием нарушений ритма сердца [41-42].
Наиболее часто болезнь обусловлена мутациями в генах десмосомальных белков - плакоглобина (JUP), десмоплакина (DSP), плакофиллина-2 (PKP2), десмоглеина-2 (DSG2) и десмоколлина-2 (DSC2). Нарушения десмосомальных контактов снижает устойчивость кардиомиоцитов к механическим воздействиям (сокращение и растяжение) и потенцирует гибель клеток. Мутация в гене TMEM43, кодирующем трансмембранный белок 43 (Transmembrane protein 43), который участвует в регуляции транскрипции других генов и организации пространственной структуры клеточного ядра, обладает очень высокой пенетрантностью, проявляется быстро прогрессирующей сердечной недостаточностью и сопровождается очень высоким риском ВСС [32-36]. Описаны аутосомно-рецессивные типы наследования АДПЖ, которым характерно сочетание кардиомиопатии с пальмарно-плантарной кератодермией и изменениями волос, которые также обусловлены мутациями генов десмосомальных белков. К ним относят болезнь Наксос и синдром Карвахала (при котором в патологический процесс вовлечён левый желудочек) [37].
У пациентов, не имеющих структурного заболевания сердца, может отмечаться идиопатическая ЖЭ (прогноз благоприятен, лечение требуется только при плохой субъективной переносимости ЖЭ или в случае развития вторичной кардиомиопатии на фоне частой ЖЭ). Основными причинами возникновения ЖЭ являются хроническая ИБС, постинфарктный кардиосклероз, гипертрофия миокарда (обусловленная гипертрофической кардиомиопатией, артериальной гипертонией, пороками аортального клапана ), воспалительные заболевания миокарда, кардиомиопатии (дилатационная, гипертрофическая, аритмогенная дисплазия миокарда правого желудочка ), инфильтративные заболевания миокарда. ЖЭ может быть следствием гликозидной интоксикации, применения антиаритмических препаратов (прежде всего I класса, реже - III класса), нарушений электролитного баланса (гипокалемия, гипомагнемия).
При желудочковой парасистолии так называемый парасистолический очаг защищен «блоком входа» от проникновения в него электрических импульсов, генерируемых с более высокой частотой в основном водителе ритма, что является первым обязательным условием проявления парасистолии. Эта защита предотвращает «разрядку» парасистолического очага и обеспечивает для него возможность генерирования импульсов с собственной периодичностью. Блок входа всегда однонаправленный и не препятствует выходу электрических импульсов из парасистолического фокуса.
В абсолютном большинстве случаев в основе пароксизмальной мономорфной ЖТ лежит механизм re-entry. Формирование условий для возникновения феномена re-entry в миокарде желудочков, в виде зон замедленного проведения возбуждения, участков мышцы сердца, неоднородных по величине рефрактерных периодов, обычно связано со значительными патологическими изменениями в миокарде. Вот почему пароксизмальная ЖТ в подавляющем большинстве случаев осложняет течение тяжелых заболеваний сердца, таких как ИБС, особенно при наличии постинфарктных рубцов и хронической аневризмы левого желудочка, воспалительных заболеваний миокарда, кардиомиопатий (дилатационная, гипертрофическая, аритмогенная дисплазия-кардиомиопатия правого желудочка ), инфильтративных заболевания миокарда.
Тахикардия типа TdP является главным, специфичным и очень опасным клиническим проявлением синдромов удлиненного интервала QT. Известны врожденные, генетически обусловленные варианты удлинения интервала QT. Приобретенные формы синдрома удлиненного интервала QT могут быть обусловлены целым рядом факторов, приводящих к замедлению процессов реполяризации миокарда желудочков. Поскольку интервал QT является частотно-зависимым показателем, тяжёлая брадикардия, связанная с дисфункцией синусового узла, либо с предсердно-желудочковой блокадой, может приводить к патологическому удлинению интервала QT с развитием TdP ( 7). Удлинение интервала QT может быть электрокардиографическим проявлением нарушений электролитного обмена (гипокалиемия, гипомагниемия) вследствие применения диуретиков или патологии надпочечников (синдром Конна), нарушения белкового питания (длительное «диетическое» голодание, неврогенная анорексия, длительное парентеральное питание ), интоксикации фосфорорганическими соединениями, гипотиреоза. Наконец, приобретенный синдром удлиненного интервала QT является одним из возможных нежелательных эффектов лекарств (антиаритмических препаратов IА и III классов, психотропных средств фенотиазинового ряда, трициклических антидепрессантов, эритромицина, фторхинолонов, противоаллергических препаратов и многих других средств). Постоянно обновляемый перечень препаратов, удлиняющих интервал QT, представлен на сайте http://www.azcert.org.
7. Рецидивирующие эпизоды желудочковой тахикардии типа torsade de pointes на фоне предсердно-желудочковой блокады III степени. Синусовая тахикардия предсердий (зубцы Р с частотой 95-105 в мин.) диссоциирует с ритмом желудочков с частотой 28-35 в мин. Значения интервала QT составляют 550-620 мс.
При отсутствии патологического удлинения интервала QT, полиморфная ЖТ наиболее часто бывает следствием острой ишемии миокарда, прежде всего острого инфаркта миокарда, а также других форм острого повреждения миокарда.
В настоящее время выделяют две основные причины врождённых желудочковых нарушений ритма сердца - так называемую «первичную электрическую болезнь сердца» («primary electric heart disease»), которую обнаруживают у лиц, не имеющих признаков органической патологии сердечно-сосудистой системы, и врождённые структурные заболевания сердца.
Основной причиной генетически детерминированных желудочковых аритмий при «первичной электрической болезни сердца» является дисфункция ионных каналов и насосов, играющих важнейшую роль в процессах деполяризации и реполяризации. В англоязычной литературе данные состояния обозначают также термином «каналопатии» («channelopathies»). К ним относят синдром удлиненного интервала QT, синдром Бругада, синдром укороченного интервала QT и катехоламинергическую полиморфную желудочковую тахикардию. Общими клиническими проявлениями данных заболеваний являются приступы потери сознания, обусловленные рецидивами желудочковой тахикардии (ЖТ), чаще TdP, случаи внезапной сердечной смерти (ВСС) при отсутствии признаков структурного заболевания сердца и наследственный характер заболевания [11-12].
Наследственный синдром удлинённого интервала QT (СУИQT, в англоязычной литературе - Long QT syndrome - LQTS или LQT) является наиболее частым и наиболее изученным из данных заболеваний, проявляющимся удлинением интервала QT на ЭКГ [при отсутствии других вызывающих это изменение причин], рецидивирующими синкопальными и пресинкопальными состояниями вследствие пароксизмов TdP, а также случаями ВСС [13-16].
Описаны следующие фенотипические формы СУИQT: синдром Романо-Уорда (Romano-Ward), синдром Джервелла и Ланге-Нильсена (Jervell and Lange-Nielsen), синдром Андерсена-Тавила (Andresen-Tawil) и синдром Тимоти (Timothy).
Наиболее распространённая форма заболевания с аутосомно-доминантным типом наследования - синдром Романо-Уорда, характерными клиническими проявлениями которого являются увеличение продолжительности интервала QT, рецидивирующие синкопальные состояния, чаще всего обусловленные полиморфной желудочковой тахикардией (ЖТ) типа пируэт, и наследственный характер заболевания. Более 90% случаев синдрома Романо-Уорда представлены СУИQT 1-го (СУИQT1), 2-го (СУИQT2) и 3-го (СУИQT3) типов, имеющих особенности клинических и электрокардиографических проявлений (табл. 1, 8).
Таблица 1. Клиническая характеристика основных типов наследственного синдрома удлинённого интервала QT.
| Характеристика | СУИQT1 | СУИQT2 | СУИQT3 |
| Мутантный ген | KCNQ1 | KCNH2 | SCN5A |
| Изменение ионного тока | Снижение IKs | Снижение IKr | Усиление INa |
| Особенности реполяризации на синусовом ритме | Широкая, симметричная волна Т | Низкая амплитуда волны Т, двухфазная волна Т | Удлиненный изоэлектрический сегмент ST |
| Факторы, провоцирующие индукцию TdP | Физическая нагрузка, эмоциональный стресс | Резкий громкий звук, эмоциональный стресс (испуг), резкое начало физической нагрузки | Брадикардия (в покое, во сне) |
| Динамика QTс на нагрузке | Удлинение | Укорочение (нормальная динамика) | Значительное укорочение |
| Эффективность терапии β-адреноблокаторами | Высокая (более 80%) | Умеренная (около 50%) | Низкая (неизвестна) |
| Динамика QTс при приёме ААП I класса | Нет | Нет | Укорочение |
| Примечание: СУИQT - синдром удлинённого интервала QT; TdP - Torsade de Pointes; ААП -антиаритмический препарат | |||
8. Изменения ЭКГ при различных типах наследственного синдрома удлиненного интервала QT: (А) - широкая гладкая волна T при СУИQT1; (Б) - двухфазная T-волна при СУИQT2; (В) - низкоамплитудная и укороченная T-волна с удлиненным, горизонтальным ST-сегментом при СУИQT3.
Существенно реже встречается аутосомно-рецессивная форма заболевания (синдром Джервелла и Ланге-Нильсена; мутации в генах KCNQ1 и KCNE1), для которой характерны врождённая нейросенсорная тугоухость, более выраженное увеличение длительности интервала QT и большая частота опасных для жизни желудочковых аритмий.
Синдром Андерсена-Тавила - редкая форма заболевания, при которой удлинение интервала QT сопровождается появлением волны U, пароксизмами как полиморфной желудочковой тахикардии типа TdP, так и двунаправленной желудочковой тахикардии. Обычно заболевание обусловлено мутацией в гене KCNJ2, кодирующем α-субъединицу калиевых каналов Kir2,1, генерирующих ток IK1. Характерные экстракардиальные проявления заболевания, такие как аномалии развития костной системы (низкорослость, микрогнатия, большое расстояние между глазницами, низкое расположение ушных раковин, сколиоз, клинодактилиия), гипокалемия и периодический калий-зависимый паралич, присутствуют не у всех больных. Синдром Андерсена-Тавила - заболевание с аутосомно-доминантным типом наследования, однако семейный характер заболевания прослеживается далеко не всегда, в связи с трудностями диагностики, неспецифическими клиническими проявлениями заболевания и неполной пенетрантностью мутантных генов. До 50% случаев заболевания обусловлены мутацией de novo.
Синдром Тимоти - крайне редкая форма СУИQT, обусловленная мутацией в гене сACNA1c, кодирующем α-субъединицу кальциевых каналов сaV1,2. При данном синдроме отмечают наиболее выраженное удлинение интервалов QT и QTc (до 700 мс), сопровождающееся крайне высоким риском ВСС (средняя продолжительность жизни составляет 2,5 года). До 60% больных имеет различные врождённые пороки сердца и различные нарушения проводимости. Среди экстракардиальных проявлений заболевания описаны когнитивные нарушения, гипогликемия, иммунодефициты, аномалии строения лица, частичное или полное сращение пальцев кистей и стоп (синдактилия). Синдром Тимоти наследуется по аутосомно-доминантному типу, однако подавляющее большинство случаев заболевания обусловлено мутацией de novo [16].
Синдром Бругада, характеризующийся ЭКГ признаками блокады правой ножки пучка Гиса с элевацией точки J и сегмента ST в правых прекордиальных отведениях и проявляющийся клинически рецидивирующими синкопальными состояниями, а также случаями ВСС, которая наступает чаще у лиц мужского пола в возрасте 30-40 лет, назван в честь исследователей, описавших взаимосвязь этих проявлений в 1992 г. Заболевание наследуется по аутосомно-доминантному типу, при этом характерна неполная пенетрантность генетических изменений. Синдром Бругада вызывают мутации в гене α-субъединицы натриевых каналов SCN5A, приводящие к уменьшению силы входящего натриевого тока (INa) [18-22].
Желудочковые тахикардии, (преимущественно полиморфная, крайне редко - мономорфная) характеризующиеся высоким риском трансформации в фибрилляцию желудочков, являются основным клиническим проявлением синдрома Бругада. Характерно их возникновение в покое, во время ночного сна, что делает более вероятным их выявление с помощью ХМ ЭКГ, а не при стандартной записи ЭКГ ( 9). Одним из клинических проявлений, сопровождающих эти аритмические события, могут быть эпизоды хриплого (агонального) дыхания во сне. Желудочковые тахикардии могут провоцироваться лихорадочными состояниями, а также рядом лекарственных препаратов (перечень представлен на сайте http://brugadadrugs.org). Симптомы заболевания проявляются обычно у взрослых, а средний возраст ВСС составляет 41±15 лет. При синдроме Бругада чаще чем в общей популяции регистрируют случаи суправентрикулярных тахиаритмий [23-24].
9. Неустойчивый пароксизм (выделен рамкой) полиморфной желудочковой тахикардии (частота сердечных сокращений 160-180 уд./мин. Холтеровская мониторная запись ЭКГ в 12 отведениях у больного синдрома Бругада. Время возникновения пароксизма - 23 часа. Стрелками в отведении V1 указана элевация точки J в сокращениях синусового ритма.
Катехоламинергическая полиморфная ЖТ (Catecholaminergic polymorphic ventricular tachycardia; сPVT) - наследственное заболевание, проявляющееся пароксизмами полиморфной или двунаправленной ЖТ, возникающими на фоне физической нагрузки или эмоционального стресса ( 10), нередко протекающими с потерей сознания. Заболевание обусловлено нарушениями внутриклеточного обмена ионов сa2+ вследствие мутаций генов RyR2 (наследуется аутосомно-доминантно) и сASQ2 (наследуется аутосомно-рецессивно). Характеризуется злокачественным течением и высоким риском ВСС при отсутствии адекватного лечения [25-26].
10. Эпизоды катехоламин-зависимой полиморфной желудочковой тахикардии из 16 комплексов (А), 10 комплексов (Б), 11 комплексов (С), с частотой 260-307 уд./мин, зарегистрированные при суточном мониторировании ЭКГ по Холтеру во время эмоционального стресса (напряженный разговор по телефону) у больного 36 лет.
Синдром укороченного интервала QT (Short QT Syndrome; ShortQTS) является редким заболеванием, при котором на ЭКГ регистрируют уменьшение продолжительности интервалов QT/QTc и высокий симметричный зубец T в правых прекордиальных отведениях ( 11). Основными клиническими проявлениями заболевания являются синкопальные состояния, обусловленные пароксизмами ЖТ, что сопровождается повышенным риском ВСС. Наследование осуществляется по аутосомно-доминантному типу. Заболевание вызывают мутации в генах калиевых каналов (KCNH2, KCNQ1, KCNJ2), приводящие к усилению генерируемых ими токов К+, укорочению длительности фазы реполяризации потенциала действия и уменьшению продолжительности рефрактерных периодов возбудимых тканей сердца, что предрасполагает возникновению аритмий по механизму re-entry [27-28].
11. ЭКГ пациента с синдромом укороченного интервала QT. Высокоамплитудные симметричные зубцы T в V2-V4. QT = 220 мс.
Существует целый ряд наследственных структурных заболеваний сердца, проявляющихся тяжелыми желудочковыми тахиаритмиями и случаями ВСС, наличие которых может быть ведущим клиническим симптомом заболевания, определяющим прогноз жизни пациента.Наиболее распространёнными из них являются гипертрофическая и дилатационная кардиомиопатии, а также аритмогенная дисплазия-кардиомиопатия правого желудочка (АДПЖ).
АДПЖ - генетически детерминированное заболевание сердца, которому характерно замещение миокарда преимущественно правого желудочка (ПЖ) жировой и соединительной тканями. Клинически заболевание проявляется нарушениями ритма сердца - ЖЭ и ЖТ, сопровождающимися высоким риском ВСС у лиц молодого возраста (АДПЖ является одной из ведущих причин ВСС в возрасте до 30 лет), а также прогрессирующей сердечной недостаточностью [29-31].
АДПЖ - прогрессирующее заболевание, в клиническом течении которого выделяют следующие стадии:
• Начальная субклиническая стадия, во время которой проявления заболевания отсутствуют.
• Стадия «электрических» проявлений, во время которой имеющиеся у пациентов структурные поражения ещё не приводят к снижению систолической функции миокарда, но могут способствовать возникновению нарушений ритма сердца и ВСС [32-34].
• Стадия правожелудочковой недостаточности развивается по мере прогрессирования заболевания, при большем объёме зоны поражения миокарда правого желудочка [35-37].
• Терминальная стадия, проявляющаяся бивентрикулярной недостаточностью, симптомы которой могут быть полностью аналогичны дилатационной кардиомиопатии [38-40].
Клинические проявления АДПЖ могут быть обусловлены как нарушениями ритма сердца, так и прогрессирующей сердечной недостаточностью. Выделяют следующие варианты клинического течения АДПЖ:
• скрытый, при котором ВСС может быть единственным проявлением заболевания;
• аритмический, которому характерны ЖЭ и ЖТ, исходящие из правого желудочка, с морфологией комплексов QRS по типу блокады левой ножки пучка Гиса (БЛНПГ);
• проявляющийся сердечной недостаточностью, преимущественно правожелудочковой, с наличием или отсутствием нарушений ритма сердца [41-42].
Наиболее часто болезнь обусловлена мутациями в генах десмосомальных белков - плакоглобина (JUP), десмоплакина (DSP), плакофиллина-2 (PKP2), десмоглеина-2 (DSG2) и десмоколлина-2 (DSC2). Нарушения десмосомальных контактов снижает устойчивость кардиомиоцитов к механическим воздействиям (сокращение и растяжение) и потенцирует гибель клеток. Мутация в гене TMEM43, кодирующем трансмембранный белок 43 (Transmembrane protein 43), который участвует в регуляции транскрипции других генов и организации пространственной структуры клеточного ядра, обладает очень высокой пенетрантностью, проявляется быстро прогрессирующей сердечной недостаточностью и сопровождается очень высоким риском ВСС [32-36]. Описаны аутосомно-рецессивные типы наследования АДПЖ, которым характерно сочетание кардиомиопатии с пальмарно-плантарной кератодермией и изменениями волос, которые также обусловлены мутациями генов десмосомальных белков. К ним относят болезнь Наксос и синдром Карвахала (при котором в патологический процесс вовлечён левый желудочек) [37].
Epidemiology
Одиночная ЖЭ нередко регистрируется при записи стандартной ЭКГ у здоровых лиц молодого и среднего возраста (0,5-2% случаев), и еще чаще обнаруживается у них с помощью амбулаторного Холтеровского мониторирования ЭКГ (ХМ ЭКГ). Количественные проявления ЖЭ увеличиваются с возрастом. Более сложные формы ЖЭ (парная, политопная) также могут обнаруживаться у здоровых лиц, но их появление более вероятно в связи с наличием основного заболевания, как этиологического фактора [1-5].
Данные о распространённости ЖТ в популяции отсутствуют в связи с тем, что различные формы ЖТ могут иметь схожие клинические проявления, а также в связи с тем, что первым и единственным проявлением ЖТ может быть внезапная смерть.
Ежегодно в мире регистрируются сотни тысяч случаев внезапной смерти. В развитых странах ее частота составляет 1-2 случая на 1000 населения в год, что соответствует 13-15% (по некоторым данным до 25%) всех случаев естественной смерти. ВСС бывает первым и нередко единственным проявлением ИБС, при которой 50% случаев смерти внезапны, а среди больных с хронической сердечной недостаточностью внезапно умирают более половины [3-4].
Распространенность СУИQT в популяции составляет около 1:2000 новорождённых. Следует отметить, что эти данные учитывают только случаи «явного» увеличения продолжительности интервала QT, выявленного при регистрации ЭКГ. У некоторых больных симптомов заболевания могут полностью отсутствовать в течение всей жизни и проявляться лишь при возникновении дополнительных факторов, способствующих удлинению интервала QT, например, гипокалемии, или при назначении лекарственных препаратов, способных увеличивать длительность интервала QT. Кроме того, удлинение интервала QT может носить преходящий характер, следовательно, истинная распространённость данного заболевания в популяции, по-видимому, ещё больше. Приобретенный СУИQT, обусловленный действием лекарственных препаратов или других преходящих факторов, встречается намного чаще [12].
Распространённость синдрома Бругада в общей популяции в настоящее время неизвестна. Существенно чаще оно встречается в странах Юго-Восточной Азии (Азиатско-Тихоокеанский регион), где его распространённость достигает 0,5-1:1000. Синдром Бругада у мужчин встречается в 8-10 раз чаще, чем у женщин [20-21].
Истинная распространённость катехоламинергической полиморфной ЖТ в общей популяции неизвестна, поскольку вне приступа у больных на ЭКГ отсутствуют какие-либо специфические изменения. По некоторым данным, она может достигать 1:10 000 [26].
Распространённость АДПЖ в общей популяции составляет около 1:2500-1:5000, при этом следует отметить неоднородность географического распределения. Заболевание несколько чаще встречают у мужчин, чем у женщин (соотношение 2,7:1) [33].
Данные о распространённости ЖТ в популяции отсутствуют в связи с тем, что различные формы ЖТ могут иметь схожие клинические проявления, а также в связи с тем, что первым и единственным проявлением ЖТ может быть внезапная смерть.
Ежегодно в мире регистрируются сотни тысяч случаев внезапной смерти. В развитых странах ее частота составляет 1-2 случая на 1000 населения в год, что соответствует 13-15% (по некоторым данным до 25%) всех случаев естественной смерти. ВСС бывает первым и нередко единственным проявлением ИБС, при которой 50% случаев смерти внезапны, а среди больных с хронической сердечной недостаточностью внезапно умирают более половины [3-4].
Распространенность СУИQT в популяции составляет около 1:2000 новорождённых. Следует отметить, что эти данные учитывают только случаи «явного» увеличения продолжительности интервала QT, выявленного при регистрации ЭКГ. У некоторых больных симптомов заболевания могут полностью отсутствовать в течение всей жизни и проявляться лишь при возникновении дополнительных факторов, способствующих удлинению интервала QT, например, гипокалемии, или при назначении лекарственных препаратов, способных увеличивать длительность интервала QT. Кроме того, удлинение интервала QT может носить преходящий характер, следовательно, истинная распространённость данного заболевания в популяции, по-видимому, ещё больше. Приобретенный СУИQT, обусловленный действием лекарственных препаратов или других преходящих факторов, встречается намного чаще [12].
Распространённость синдрома Бругада в общей популяции в настоящее время неизвестна. Существенно чаще оно встречается в странах Юго-Восточной Азии (Азиатско-Тихоокеанский регион), где его распространённость достигает 0,5-1:1000. Синдром Бругада у мужчин встречается в 8-10 раз чаще, чем у женщин [20-21].
Истинная распространённость катехоламинергической полиморфной ЖТ в общей популяции неизвестна, поскольку вне приступа у больных на ЭКГ отсутствуют какие-либо специфические изменения. По некоторым данным, она может достигать 1:10 000 [26].
Распространённость АДПЖ в общей популяции составляет около 1:2500-1:5000, при этом следует отметить неоднородность географического распределения. Заболевание несколько чаще встречают у мужчин, чем у женщин (соотношение 2,7:1) [33].
Classification
ЖЭ, исходящие из одного источника (монотопные), характеризуются одинаковой морфологией комплексов QRS и постоянной (фиксированной) величиной интервала сцепленияПолитопная экстрасистолия проявляется различными по форме комплексами QRS, возникающими с разными интервалами сцепленияЕсли экстрасистолический комплекс накладывается на зубец Т предшествующего комплекса QRST основного ритма, то такая экстрасистолия называется ранней или экстрасистолией типа R на Т (R/T). Смысл выделения этого типа экстрасистолии заключается в том, что, при наличии определенных условий именно ранние ЖЭ чаще всего, индуцируют ЖТ и ФЖ.
Иногда может прослеживаться кратность появления ЖЭ экстрасистол в отношении к синусовому ритму, что именуется аллоритмиейСостояния, при которых экстрасистола является каждым вторым, третьим или четвертым сокращением, называются би-, три- и квадригеминией, соответственно (рис. 12). ЖЭ может быть одиночной и парной ( 13). Три и более следующих подряд желудочковых эктопических комплекса, по определению, квалифицируются как желудочковый ритм или желудочковая тахикардия, если частота следования эктопических комплексов превышает 100 в 1 мин. Термин «групповая экстрасистолия», который иногда применяется в отношении 3-5 следующих подряд ЖЭ, следует считать неправильным.
12. Желудочковая бигеминия (Холтеровская мониторная запись ЭКГ).
13. Парная желудочковая экстрасистолия, протекающая как парная тригеминия (Холтеровская мониторная запись ЭКГ).
Регулярность сердечного ритма нарушается желудочковыми экстрасистолами не только вследствие их преждевременности, но и в результате возникновения постэкстрасистолических пауз (для ЖЭ характерны так называемые полные компенсаторные паузы, при которых интервал сцепления экстрасистолы в сумме с постэкстрасистолической паузой приблизительно равны по продолжительности суммарной величине двух нормальных сердечных циклов [ см 1]).Нечастым явлением, которое может наблюдаться на фоне синусовой брадикардии, являются вставочные или интерполированные ЖЭ, не имеющие компенсаторных пауз.
• Градация 0 - желудочковые нарушения ритма сердца отсутствуют.
• Градация 1 - редкая (не более 30 в час) монотопная ЖЭ.
• Градация 2 - частая (более 30 в час) монотопная ЖЭ.
• Градация 3 - политопная ЖЭ.
• Градация 4А - две последовательные (парные) ЖЭ.
• Градация 4Б - несколько подряд (три и более) желудочковых эктопических сокращений - «пробежки» ЖТ.
• Градация 5 - ранняя ЖЭ типа R/T.
Градационная классификация имеет важнейшее значение для оценки результатов ХМ ЭКГ. Однако она основывается только на электрокардиографических проявлениях ЖЭ. Риск возникновения угрожающих жизни желудочковых аритмий (желудочковой тахикардии, трепетания и фибрилляции желудочков), который имеет связь с желудочковой экстрасистолией, как с провоцирующим фактором, решающим образом зависит прежде всего от характера и степени тяжести основной сердечной патологии.
Важное значение для клинической практики имеет классификация (риск-стратификация), предложенная T. вigger в 1984 г. Она предполагает проведение анализа не только характера желудочковой эктопической активности, но и ее клинических проявлений, а также наличия или отсутствия органического поражения сердца как причины ее возникновения. В соответствии с этими признаками выделяются 3 категории желудочковых аритмий [7].
• К доброкачественным желудочковым аритмиям относится ЖЭ, возникающая у лиц, не имеющих признаков заболевания сердца («идиопатические» желудочковые аритмии). Прогноз жизни этих больных благоприятен, в связи с очень малой вероятностью возникновения фатальных желудочковых аритмий (ФЖ), не отличающейся от таковой в общей популяции. Профилактика ВСС не требуется, однако необходимо динамическое наблюдение, поскольку у части больных ЖЭ может быть первым клиническим проявлением той или иной сердечной патологии.
• Принципиальным отличием потенциально злокачественных желудочковых аритмий от предыдущей категории служит наличие органического заболевания сердца, как причины их возникновения. Чаще всего это различные формы ИБС (наиболее значим перенесенный инфаркт миокарда), поражение сердца при артериальной гипертонии, первичные заболевания миокарда Особое дополнительное значение имеют снижение фракции выброса левого желудочка и симптомы хронической сердечной недостаточности. У этих больных с ЖЭ (потенциальным пусковым фактором ЖТ и ФЖ) еще не было пароксизмов ЖТ, эпизодов ТЖ или ФЖ, но вероятность их возникновения довольно высока, а риск ВСС характеризуется как существенный. Всем таким больным должна осуществляться первичная профилактика ВСС.
• Категорию злокачественных желудочковых аритмий формируют устойчивые пароксизмы ЖТ и пережитые благодаря успешной реанимации случаи ВСС у лиц с органическим заболеванием сердца. Прогноз жизни этих больных крайне неблагоприятен, всем им должна осуществляться вторичная профилактика ВСС.
Отдельно выделяют неустойчивую (менее 30 сек) ЖТ у больных со структурным заболеванием сердца. Пароксизмы неустойчивой ЖТ, при которых успевают развиваться острые тяжелые нарушения гемодинамики, по своей тяжести и значению для прогноза жизни должны приравниваться к устойчивой ЖТ, однако чаще такие нарушения ритма протекают без тяжёлых клинических проявлений. Для уточнения индивидуальной степени риска ВСС таким больным показано проведение внутрисердечного ЭФИ.
Иногда может прослеживаться кратность появления ЖЭ экстрасистол в отношении к синусовому ритму, что именуется аллоритмиейСостояния, при которых экстрасистола является каждым вторым, третьим или четвертым сокращением, называются би-, три- и квадригеминией, соответственно (рис. 12). ЖЭ может быть одиночной и парной ( 13). Три и более следующих подряд желудочковых эктопических комплекса, по определению, квалифицируются как желудочковый ритм или желудочковая тахикардия, если частота следования эктопических комплексов превышает 100 в 1 мин. Термин «групповая экстрасистолия», который иногда применяется в отношении 3-5 следующих подряд ЖЭ, следует считать неправильным.
12. Желудочковая бигеминия (Холтеровская мониторная запись ЭКГ).
13. Парная желудочковая экстрасистолия, протекающая как парная тригеминия (Холтеровская мониторная запись ЭКГ).
Регулярность сердечного ритма нарушается желудочковыми экстрасистолами не только вследствие их преждевременности, но и в результате возникновения постэкстрасистолических пауз (для ЖЭ характерны так называемые полные компенсаторные паузы, при которых интервал сцепления экстрасистолы в сумме с постэкстрасистолической паузой приблизительно равны по продолжительности суммарной величине двух нормальных сердечных циклов [ см 1]).Нечастым явлением, которое может наблюдаться на фоне синусовой брадикардии, являются вставочные или интерполированные ЖЭ, не имеющие компенсаторных пауз.
1,6, Классификация в стратификации риска внезапной сердечной смерти.
Тесная связь ВСС с некоторыми формами желудочковых нарушений ритма сердца делает необходимым проведение их риск-стратификации, ранжирования по степени риска развития ФЖ. Первая попытка такой стратификации была предпринята в. Lown и M. Wolf, которые предложили в 1971 г. градационную классификацию желудочковых аритмий, зарегистрированных при ХМ ЭКГ. Классификация выделяет следующие градации:• Градация 0 - желудочковые нарушения ритма сердца отсутствуют.
• Градация 1 - редкая (не более 30 в час) монотопная ЖЭ.
• Градация 2 - частая (более 30 в час) монотопная ЖЭ.
• Градация 3 - политопная ЖЭ.
• Градация 4А - две последовательные (парные) ЖЭ.
• Градация 4Б - несколько подряд (три и более) желудочковых эктопических сокращений - «пробежки» ЖТ.
• Градация 5 - ранняя ЖЭ типа R/T.
Градационная классификация имеет важнейшее значение для оценки результатов ХМ ЭКГ. Однако она основывается только на электрокардиографических проявлениях ЖЭ. Риск возникновения угрожающих жизни желудочковых аритмий (желудочковой тахикардии, трепетания и фибрилляции желудочков), который имеет связь с желудочковой экстрасистолией, как с провоцирующим фактором, решающим образом зависит прежде всего от характера и степени тяжести основной сердечной патологии.
Важное значение для клинической практики имеет классификация (риск-стратификация), предложенная T. вigger в 1984 г. Она предполагает проведение анализа не только характера желудочковой эктопической активности, но и ее клинических проявлений, а также наличия или отсутствия органического поражения сердца как причины ее возникновения. В соответствии с этими признаками выделяются 3 категории желудочковых аритмий [7].
• К доброкачественным желудочковым аритмиям относится ЖЭ, возникающая у лиц, не имеющих признаков заболевания сердца («идиопатические» желудочковые аритмии). Прогноз жизни этих больных благоприятен, в связи с очень малой вероятностью возникновения фатальных желудочковых аритмий (ФЖ), не отличающейся от таковой в общей популяции. Профилактика ВСС не требуется, однако необходимо динамическое наблюдение, поскольку у части больных ЖЭ может быть первым клиническим проявлением той или иной сердечной патологии.
• Принципиальным отличием потенциально злокачественных желудочковых аритмий от предыдущей категории служит наличие органического заболевания сердца, как причины их возникновения. Чаще всего это различные формы ИБС (наиболее значим перенесенный инфаркт миокарда), поражение сердца при артериальной гипертонии, первичные заболевания миокарда Особое дополнительное значение имеют снижение фракции выброса левого желудочка и симптомы хронической сердечной недостаточности. У этих больных с ЖЭ (потенциальным пусковым фактором ЖТ и ФЖ) еще не было пароксизмов ЖТ, эпизодов ТЖ или ФЖ, но вероятность их возникновения довольно высока, а риск ВСС характеризуется как существенный. Всем таким больным должна осуществляться первичная профилактика ВСС.
• Категорию злокачественных желудочковых аритмий формируют устойчивые пароксизмы ЖТ и пережитые благодаря успешной реанимации случаи ВСС у лиц с органическим заболеванием сердца. Прогноз жизни этих больных крайне неблагоприятен, всем им должна осуществляться вторичная профилактика ВСС.
Отдельно выделяют неустойчивую (менее 30 сек) ЖТ у больных со структурным заболеванием сердца. Пароксизмы неустойчивой ЖТ, при которых успевают развиваться острые тяжелые нарушения гемодинамики, по своей тяжести и значению для прогноза жизни должны приравниваться к устойчивой ЖТ, однако чаще такие нарушения ритма протекают без тяжёлых клинических проявлений. Для уточнения индивидуальной степени риска ВСС таким больным показано проведение внутрисердечного ЭФИ.
Diagnostics
2,1 Жалобы и анамнез.
• Рекомендуется при опросе пациента с ЖЭ оценить тяжесть клинических проявлений ЖЭ. [4-5].Уровень убедительности I ( уровень достоверности с ).
Комментарий. Характер клинической симптоматики ЖЭ, а также ее значение для прогноза здоровья и жизни пациентов зависят от форм проявления самой экстрасистолии, но в еще большей степени - от основного заболевания, как причины ее возникновения. Редкая одиночная ЖЭ у лиц, не имеющих признаков органической патологии со стороны сердца, может протекать бессимптомно или малосимптомно, проявляясь лишь ощущением перебоев со стороны сердца, периодически беспокоящих пациентов. Частая экстрасистолия с периодами бигеминии, особенно у больных со сниженными показателями сократительной функции сердца (ИБС, кардиомиопатии, другие формы поражения миокарда), помимо перебоев, может приводить к снижению артериального давления, появлению чувства слабости, головокружению, появлению и нарастанию одышки [4-5].
Клинические проявления желудочковой парасистолии аналогичны ЖЭ.
• При опросе пациента со структурным заболеванием сердца, имеющего высокий риск желудочковых аритмий, рекомендуется целенаправленно выяснять наличие жалоб, которые потенциально могут быть обусловлены пароксизмальными желудочковыми аритмиями. [4-5].
Уровень убедительности I ( уровень достоверности с ).
Комментарий. Клинические проявления пароксизмальных желудочковых тахикардий могут существенно различаться в зависимости от состояния гемодинамики - в лёгких случаях больные могут отмечать лишь учащённое сердцебиение, дискомфорт в груди (в ряде случаев проявления и вовсе отсутствуют), в тяжёлых - интенсивную загрудинную боль, удушье, головокружение, пресинкопальные и синкопальные состояния. Тяжесть клинических проявлений зависит от частоты сердечных сокращений во время пароксизма, наличия или отсутствия структурного заболевания сердца и сопутствующей патологии (например, атеросклероз брахиоцефальных артерий).
• Рекомендуется исключить диагноз желудочковой тахикардии при отсутствие признаков гемодинамической нестабильности во время пароксизмов.[4-5].
Уровень убедительности I ( уровень достоверности с ).
• Желудочковые нарушения ритма рекомендуется рассматривать в качестве одной из вероятных причин синкопальных состояний у больных со структурным заболеванием сердца, особенно у пациентов, перенесших острый инфаркт миокарда, со сниженной фракцией выброса левого желудочка.[4-5].
Уровень убедительности I ( уровень достоверности с ).
• СУИQT и катехоламинергическая полиморфная ЖТ рекомендуется рассматривать в качестве возможных причин синкопальных состояний, возникающих на высоте физической или эмоциональной нагрузки, особенно у молодых пациентов, не имеющих структурного заболевания сердца.[4-5].
Уровень убедительности I ( уровень достоверности с ).
• При сборе анамнеза больных СУИQT рекомендуется особое внимание уделять принимаемым пациентом лекарственным препаратам, поскольку удлинение интервала QT могут вызывать многие некардиологические лекарственные средства (постоянно обновляемый перечень представлен на сайте http://www.azcert.org).[4-5].
Уровень убедительности I ( уровень достоверности с ).
• При подозрении генетически детерминированных желудочковых нарушений ритма сердца рекомендован сбор семейного анамнеза, нацеленный на выявление случаев внезапных и необъяснимых смертей (например, утопление) близких родственников в молодом возрасте.[4-5].
Уровень убедительности I (уровень достоверности с).
2,2 Физикальное обследование.
• Выявление признаков гемодинамической нестабильности рекомендовано при физикальном обследовании пациентов с пароксизмальными нарушениями ритма сердца. [3-4, 10].Уровень убедительности I ( уровень достоверности А ).
Комментарий. При подавляющем большинстве желудочковых нарушений ритма сердца при физикальном обследовании пациентов вне пароксизма какие-либо изменения не отмечаются.
Внеочередные сердечные сокращения (экстрасистолы) могут быть отмечены при подсчёте пульса, измерении артериального давления или аускультации сердца пациента.
В редких случаях при обследовании больных врождённым СУИQT или АДПЖ возможно обнаружение аномалий органов чувств (врождённая глухота) и костно-суставной системы.
2,3 Лабораторная диагностика.
• Во всех случаях рекомендовано обследование на подтверждение или исключение преходящих (корригируемых) факторов, значимых для возникновения желудочковых аритмий (прием сердечных гликозидов, антиаритмических препаратов, уровень калия и магния в сыворотке крови, признаки острого инфаркта миокарда ).[4-5].Уровень убедительности I ( уровень достоверности с ).
• Пациентам со значимым удлинением интервала QT на ЭКГ рекомендовано проведение комплекса анализов для выявления преходящих причин (например, гипотиреоз, гипокалемия )[4-5].
Уровень убедительности I ( уровень достоверности с ).
• Больным, у которых на ЭКГ регистрируются признаки синдрома Бругада, рекомендовано проведение комплекса анализов для выявления преходящих причин (например, острый коронарный синдром, тромбоэмболия лёгочной артерии, перикардит и др).[4-5].
Уровень убедительности I ( уровень достоверности с ).
2,4 Инструментальная диагностика.
• ЭКГ в 12-ти отведениях в покое рекомендована всем пациентам, которые проходят обследование на предмет желудочковых аритмий. [4-5].Уровень убедительности I ( уровень достоверности А ).
• Амбулаторное (Холтеровское) мониторирование ЭКГ в 12-ти отведениях рекомендуется для выявления и диагностики нарушений ритма сердца, для оценки изменений интервала QT и изменений сегмента ST. [5].
Уровень убедительности I ( уровень достоверности А ).
• При спорадических симптомах рекомендовано использование регистратора событий для выявления возможных транзиторных аритмий, способных вызывать такие симптомы. [5].
Уровень убедительности I ( уровень достоверности В ).
• Взрослым пациентам, у которых по возрасту или по характеру симптомов вероятна ИБС, рекомендована проба с дозированной физической нагрузкой, с целью диагностической провокации ишемических изменений ЭКГ и/или желудочковых аритмий. [5].
Уровень убедительности I ( уровень достоверности В ).
• Проба с дозированной физической нагрузкой рекомендована пациентам, если известно или предполагается, что желудочковые аритмии, провоцируются физической нагрузкой, для установки диагноза и определения прогноза. [5].
Уровень убедительности I ( уровень достоверности В ).
• Проба с дозированной физической нагрузкой может быть рекомендована для оценки результатов медикаментозной терапии или аблации, если известно, что желудочковые аритмии провоцируются физической нагрузкой. [5].
Уровень убедительности IIa (уровень достоверности С).
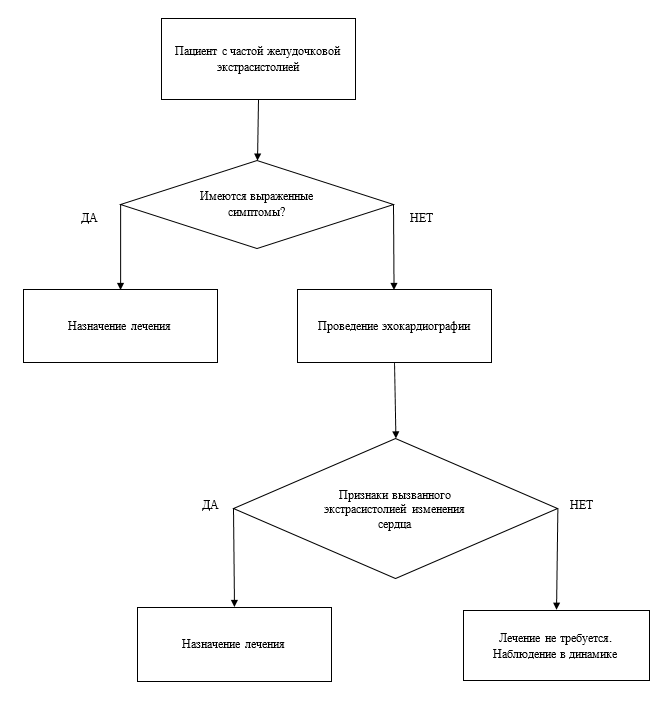
• Эхокардиография рекомендована всем пациентам с предполагаемыми или известными желудочковыми аритмиями, для оценки функции ЛЖ и выявления структурной патологии сердца. [4-5].
Уровень убедительности I ( уровень достоверности В ).
• Эхокардиография с целью оценки функции ЛЖ и ПЖ и выявления структурной патологии сердца рекомендована пациентам с высоким риском опасных для жизни желудочковых аритмий или внезапной смерти, в том числе пациентам с дилатационной, гипертрофической или правожелудочковой кардиомиопатией, лицам, пережившим острый инфаркт миокарда, а также родственникам пациентов с наследственными заболеваниями, сопряженными с высоким риском внезапной смерти. [4-5].
Уровень убедительности I ( уровень достоверности В ).
• Проба с дозированной физической нагрузкой в сочетании с визуализацией сердца (стресс-эхокардиография или перфузионная однофотонная эмиссионная компьютерная томография с нагрузкой) рекомендована для выявления бессимптомной ишемии миокарда у тех больных желудочковой аритмией, которые, с учетом возраста и симптоматики, имеют вероятность ИБС, и у которых ЭКГ не дает надежной информации (применение дигоксина, гипертрофия ЛЖ, депрессия сегмента ST >1 мм в покое, WPW-синдром или блокада левой ножки пучка Гиса). [5].
Уровень убедительности I ( уровень достоверности В ).
• Лекарственный стресс-тест в сочетании с визуализацией сердца рекомендован для выявления бессимптомной ишемии миокарда тем больным желудочковыми аритмиями, которые, с учетом возраста и симптоматики, имеют вероятность ИБС, и которые физически не в состоянии выполнить пробу с дозированной физической нагрузкой. [5].
Уровень убедительности I ( уровень достоверности В ).
• Выполнении МРТ или КТ сердца у больных желудочковыми аритмиями целесообразно в случаях, когда эхокардиография не дает точной информации о функции ЛЖ и ПЖ и(или) о структурных изменениях сердца. [5].
Уровень убедительности IIa (уровень достоверности В).
2,5 Дифференцированная диагностика.
Синдром удлинённого интервала QT.• Диагноз наследственного СУИQT может быть также поставлен при повторной регистрации на ЭКГ удлинения интервала QTc до 480-499 мс у пациентов с синкопальными состояниями неясного генеза, при отсутствии генетической мутации и других причин удлинения интервала QT.[22].
Уровень убедительности I ( уровень достоверности С ).
Комментарий. Поскольку удлинение интервала QT может носить преходящий характер, в диагностике заболевания имеют значение продолжительная регистрация ЭКГ (например, суточное мониторирование ЭКГ по Холтеру; данный метод особенно информативен у больных СУИQT 2-го и 3-го типов, поскольку у больных этими формами заболевания наибольшее увеличение длительности интервала QT отмечают обычно в ночное время).
• При выявлении СУИQT рекомендовано проведение комплекса инструментальных обследований для исключения преходящих причин ( , проведение дифференциальной диагностики между врождённой и приобретёнными формами СУИQT).[22].
Уровень убедительности I ( уровень достоверности С ).
Комментарий. Удлинение интервала QT может быть вызвано целым рядом факторов, приводящих к замедлению процессов реполяризации миокарда желудочков. К ним относятся:
• брадикардия, обусловленная дисфункцией синусового узла или АВ блокадой;
• гипотиреоз;
• нарушения электролитного обмена (гипокалемия, гипомагнемия) вследствие применения диуретиков или патологии надпочечников (синдром Конна), а также профузной диареи или неукротимой рвоты;
• нарушения белкового питания (длительное «диетическое» голодание, нервная анорексия, парентеральное питание );
• острый инфаркт миокарда;
• внутричерепное кровоизлияние.
• интоксикация фосфорорганическими соединениями;
• приём лекарственных препаратов.
• Для диагностики наследственного СУИQT в сомнительных случаях целесообразны провокационные пробы.[22].
Уровень убедительности IIa (уровень достоверности С).
Комментарий. В целях обеспечения безопасности пациента и повышения диагностической значимости, существует ряд требований, которые должны быть учтены при проведении данных диагностических исследований. Поскольку в ходе исследований возможна индукция опасных для жизни нарушений ритма сердца, все провокационные пробы должны проводиться опытным медицинским персоналом при непрерывной регистрации ЭКГ (следует производить мониторирование ЭКГ до полной нормализации индуцированных в ходе исследования изменений ЭКГ, при проведении фармакологических провокационных проб - не менее 30 мин после окончания введения препарата) и систематическом измерении АД больного, в условиях непосредственной доступности необходимого для сердечно-легочной реанимации оборудования [включая дефибриллятор] и возможности незамедлительного вызова врача-реаниматолога. Проведение нагрузочных проб должны осуществлять физически тренированные сотрудники, способные уберечь пациента от падения в случае возникновения гемодинамического коллапса при индукции желудочковых аритмий.
Провокационные пробы далеко не всегда вызывают типичные для конкретного заболевания изменения ЭКГ. Пограничные изменения не должны расцениваться как диагностически значимые. В случае пограничных изменений ЭКГ или отрицательного результата исследования при большой вероятности заболевания (характерная клиническая картина, результаты генетических исследований) целесообразно проведение другой провокационной пробы.
Для выявления СУИQT используют следующие провокационные пробы.
• Активная ортостатическая проба. Оценка динамики интервала QT при регистрации ЭКГ в ходе ортостатической пробы обладает диагностической значимостью, позволяя в ряде случаев выявить больных СУИQT. После перехода в вертикальное положение отмечается умеренное увеличение частоты синусового ритма, при этом у здоровых пациентов длительность интервала QT уменьшается, а у больных СУИQT (особенно 2-го типа) продолжительность интервала QT уменьшается менее существенно, не изменяется или увеличивается.
• Проба с дозированной физической нагрузкой на велоэргометре или тредмиле. Наиболее информативна оценка длительности интервала QT в период восстановления. Длительность интервала QTc >445 мс в конце периода восстановления (спустя 4 минуты после окончания нагрузки) характерна для больных СУИQT 1-го и 2-го типов. При этом длительность интервала QTc <460 мс в начале периода восстановления позволяет отличить больных СУИQT 2-го типа от больных СУИQT 1-го типа.
• Фармакологические провокационные пробы:
Проба с адреналином (эпинефрином). Позволяет выявить больных СУИQT1, поскольку при этой форме заболевания при проведении инфузии адреналина отмечается парадоксальное увеличение длительности интервала QT. Предложены 2 протокола проведения данной пробы: протокол Шимицу (Schimizu), в ходе которого вслед за болюсным введением осуществляется кратковременная инфузия адреналина, и протокол Мейо (Mayo), в соответствии с которым осуществляется внутривенная инфузия постепенно увеличиваемой дозы адреналина. Оба этих протокола обладают сопоставимыми чувствительностью и специфичностью, хорошо переносятся и редко сопровождаются нежелательными реакциями. Проба расценивается как положительная при увеличении длительности интервала QT >30 мс на фоне инфузии адреналина в дозе до 0,1 мкг/кг в мин. Следует отметить, что правильное измерение длительности QT на фоне инфузии адреналина часто затруднено изменениями морфологии зубцов T, особенно если при этом регистрируются высокоамплитудные волны U. Сопутствующий прием β-адреноблокаторов снижает диагностическую значимость пробы. Среди нежелательных реакций, возникающих на фоне инфузии адреналина, необходимо упомянуть артериальную гипертензию и индукцию опасных для жизни нарушений ритма. Диагностическое исследование должно быть прекращено при повышении систолического АД >200 мм (или при меньших значениях в случаях, если артериальная гипертензия сопровождается выраженными клиническими проявлениями), возникновении рецидивирующих неустойчивых пробежек или индукции устойчивого пароксизма ЖТ. В случае возникновения клинически значимых нежелательных эффектов целесообразно применение короткодействующих β-адреноблокааторов, вводимых внутривенно.
Проба с аденозином. Больным СУИQT характерно увеличение продолжительности интервалов QT >410 мс и QTc >490 мс, регистрируемые во время минимальной частоты сердечных сокращений при индуцированной аденозином брадикардии. В настоящее время диагностическая значимость данной пробы изучена на ограниченном количестве больных генетически подтвержденным СУИQT, поэтому интерпретация полученных в ходе исследования результатов требует осторожности.
СУИQT следует дифференцировать от других возможных причин синкопальных состояний, учитывая относительно молодой возраст больных, прежде всего, от эпилепсии и вазо-вагальных обмороков, а также от других врождённых желудочковых нарушений ритма сердца.
Синдром Бругада.
• Рекомендуется для постановки диагноза синдрома Бругада регистрация характерных данному заболеванию изменений ЭКГ (тип А; табл. 2, 14) хотя бы в одном из правых грудных отведений при расположении электродов в стандартных или высоких (до 2-го межреберья) позициях.[22].
Уровень убедительности I ( уровень достоверности С ).
Таблица 2. ЭКГ-типы Синдрома Бругада.
| Изменения ЭКГ | Элевация по типу «свода» (Тип 1) | Элевация по типу «спинки седла» | |
| Тип 2 | Тип 3 | ||
| Элевация точки J | ≥2 мм | ≥2 мм | ≥2 мм |
| Волна Т | Отрицательная | Положительная или двухфазная | Положительная |
| Конечная часть сегмента ST | Постепенное снижение | Элевация ≥1 мм | Элевация <1 мм |
| Примечание: 1 мм = 0,1 мВ | |||
14. ЭКГ-типы Синдрома Бругада. Стрелками указана точка J. Элевация более 2.
• Изменения конечной части желудочкового комплекса, характерные для синдрома Бругада, могут иметь преходящий характер. Поэтому в тех случаях, когда имеющиеся записи ЭКГ не несут в себе признаков, в полной мере укладывающихся в диагностические критерии, но есть основание предполагать наличие синдрома Бругада, рекомендовано проведение диагностических провокационных лекарственных проб с использованием блокаторов натриевых каналов, вводимых внутривенно.[22].
Уровень убедительности I (уровень достоверности С).
Комментарий. Используют провокационные пробы с внутривенным введением аймалина (в дозе 1 мг/кг; наиболее чувствительное и специфичное исследование; препарат в России не зарегистрирован) или прокаинамида** (в дозе 10 мг/кг), позволяющих в части случаев «обнажить» признаки этого синдрома. Фармакологические провокационные пробы должны проводиться опытным медицинским персоналом при мониторировании ЭКГ больного и обязательной возможности организации реанимационных мероприятий в случае индукции опасных для жизни желудочковых аритмий под влиянием вводимых препаратов.
• Рекомендуется для постановки диагноза синдрома Бругада регистрация на ЭКГ спонтанной или индуцированной лекарственными препаратами элевации сегмента ST по типу «свода» (тип 1) хотя бы в одном из правых прекордиальных отведений (V1-V2) при расположении электродов в типичном месте или выше стандартной позиции, вплоть до II межреберье [22].
Уровень убедительности I ( уровень достоверности С ).
• При выявлении на ЭКГ изменений, характерных для синдрома Бругада, рекомендовано обследование для исключения преходящих причин.[22].
Уровень убедительности I ( уровень достоверности С ).
Комментарий. Синдром Бругада следует дифференцировать от других возможных причин синкопальных состояний, учитывая относительно молодой возраст больных, прежде всего, от эпилепсии и вазо-вагальных обмороков, а также от других врождённых желудочковых нарушений ритма сердца.
Причинами «бругадоподобных» изменений ЭКГ могут быть:
• атипичная блокада правой ножки пучка Гиса;
• гипертрофия левого желудочка;
• феномен ранней реполяризации желудочков;
• острый коронарный синдром;
• аневризма левого желудочка;
• стенокардия Принцметала;
• острый перикардит;
• гемоперикард;
• тромбоэмболия лёгочной артерии;
• расслаивающая аневризма аорты;
• электролитные нарушения (гиперкалиемия, гиперкальциемия);
• гипотермия/гипертермия;
• аритмогенная дисплазия-кардиомиопатия правого желудочка;
• механическая компрессия выносящего тракта правого желудочка (например, опухоль органов средостения);
• передозировка трициклических антидепрессантов;
• кокаиновая интоксикация;
• различные заболевания центральной и вегетативной нервной системы (субарахноидальное кровоизлияние; геморрагический инсульт; атаксия Фридриха);
• мышечная дистрофия Дюшена-Беккера.
Катехоламинергическая полиморфная желудочковая тахикардия.
• Рекомендуется проведение пробы с дозированной физической нагрузкой для постановки диагноза заболевания.[22].
Уровень убедительности I ( уровень достоверности С ).
Комментарий. Проведение нагрузочной пробы на тредмиле или велоэргометре позволяет индуцировать пароксизм полиморфной желудочковой тахикардии у многих больных. При этом характерно появление и постепенное, по мере нарастания нагрузки, увеличение желудочковой эктопической активности вплоть до индукции устойчивого пароксизма ЖТ или серии «пробежек» ЖТ. В некоторых случаях при невозможности проведения пробы с физической нагрузкой применяют фармакологические провокационные пробы с адреналином или изопротеренолом. Больным катехолоаминергической полиморфной ЖТ характерна также индукция суправентрикулярных аритмий на фоне активации адренергических влияний. Исследование должно проводится опытным медицинским персоналом, при доступности оснащения для организации реанимационных мероприятий.
• Рекомендовано мониторирование ЭКГ для верификации диагноза.[22].
Уровень убедительности I ( уровень достоверности С ).
Комментарий. Важную роль в диагностике заболевания может играть длительное мониторирование ЭКГ с помощью переносных устройств и имплантируемых петлевых регистраторов.
Синдром укороченного интервала QT.
• Рекомендовано при установке диагноза учитывать укорочения интервала QT на ЭКГ. В настоящее время диагностически значимой считается продолжительность QTc ≤340 мс.
Уровень убедительности I ( уровень достоверности С ).
• Рекомендовано установление диагноз СУИQT при продолжительности QTс <360 мс в тех случаях, когда выявлена генетическая мутация, и/или семейный анамнез отягощен случаями ВСС, и/или синдром укороченного интервала QT установлен у родственников больного, а также у тех лиц, которые пережили ВСС при отсутствии у них органического поражения сердца.[22].
Уровень убедительности IIa (уровень достоверности С).
Аритмогенная дисплазия-кардиомиопатия правого желудочка.
• Рекомендуется при подозрении АДПЖ в комплекс инструментального обследования пациентов включать регистрацию ЭКГ, Холтеровское мониторирование ЭКГ, эхокардиографию и МРТ сердца.
Уровень убедительности I ( уровень достоверности С ).
Комментарий. Для постановки диагноза АДПЖ необходимо наличие 2-х больших критериев или 1-го большого и 2-х малых критериев или 4-х малых критериев ( см приложение Г1).
15. ЭКГ больного АДПЖ. Отрицательные зубцы Т в прекордиальных отведениях V1-V5. Стрелками указаны эпсилон-волны.
2,6 Иная диагностика.
Внутрисердечное электрофизиологическое исследование.• Пациентам, имеющим характерные клинические проявления, но не имеющие ЭКГ, зарегистрированных во время приступов, а также в случаях, когда диагноз не может быть однозначно поставлен на основании ЭКГ, зарегистрированной во время пароксизма, для индукции ЖТ и верификации диагноза может требоваться проведение внутрисердечного ЭФИ. [5].
Уровень убедительности I ( уровень достоверности А ).
• Внутрисердечное ЭФИ рекомендуется для диагностического обследования пациентов с ИБС, перенесших инфаркт миокарда и имеющих симптомы, включая учащенное сердцебиение, предобморочные состояния и обмороки, позволяющие предположить наличие желудочковых тахиаритмий. [5].
Уровень убедительности I ( уровень достоверности В ).
• Внутрисердечное ЭФИ рекомендуется при жалобах на обмороки и при подозрении на брадиаритмию или тахиаритмию, с учетом симптоматики (например, учащенное сердцебиение) или результатов неинвазивного обследования, особенно для пациентов со структурной патологией сердца. [5].
Уровень убедительности I (уровень достоверности С).
• Внутрисердечное ЭФИ может быть рекомендовано для стратификации риска ВСС у больных синдромом Бругада, однако интерпретация результатов исследования требует осторожности.[5].
Уровень убедительности IIb (уровень достоверности С).
Комментарий. Отсутствие индукции ЖТ или ФЖ в ходе исследования указывает на благоприятный прогноз, однако прогностическая значимость индукции ЖТ или ФЖ в настоящее время не определена.
• Внутрисердечное ЭФИ может быть рекомендовано для стратификации риска ВСС у больных АКПЖ, однако интерпретация результатов исследования требует осторожности.[5].
Уровень убедительности IIb (уровень достоверности С).
Комментарий. Индукция ЖТ в ходе исследования указывает на неблагоприятный прогноз заболевания, однако прогностическая значимость отсутствия индукции ЖТ в настоящее время не определена.
• Внутрисердечное ЭФИ не рекомендуется для стратификации риска ВСС у больных СУИQT.[5].
Уровень убедительности III (уровень достоверности С).
• Внутрисердечное ЭФИ при катехоламинергической полиморфной ЖТ обычно неинформативно и не рекомендовано для стратификации риска ВСС.[5].
Уровень убедительности III (уровень достоверности С).
• Внутрисердечное ЭФИ не рекомендуется для стратификации риска ВСС у больных синдромом укороченного интервала QT.[5].
Уровень убедительности III (уровень достоверности С).
Длительное мониторирование ЭКГ.
• В случае, если в ходе внутрисердечного ЭФИ пароксизмальные нарушения ритма сердца не индуцированы, но при этом вероятность того, что симптомы обусловлены аритмиями высока, целесообразно продолжение длительного мониторирования ЭКГ или применение ЭКГ-регистратора событий. [5].
Уровень убедительности I ( уровень достоверности В ).
• Рекомендуется использовать имплантируемый петлевой регистратор, если симптомы, например, обмороки, являются спорадическими и могут быть связаны с аритмией, и, если не удается определить такую связь с помощью обычных методов диагностики. [5].
Уровень убедительности I ( уровень достоверности В ).
Инвазивная коронарография.
• Инвазивная коронарография рекомендуется для подтверждения или исключения значимого стенозирования коронарных артерий у пациентов с угрожающими жизни желудочковыми аритмиями и у переживших остановку сердца, которые, с учетом возраста и симптоматики, имеют вероятность ИБС. [5].
Уровень убедительности IIа (уровень достоверности С).
Рентгеноконтрастная вентрикулография и биопсия миокарда.
• Рентгеноконтрастная вентрикулография с биопсией миокарда правого желудочка рекомендуется для диагностики АДПЖ в случае, если диагноз не может быть поставлен/исключён на основании результатов других неинвазивных исследований.
Уровень убедительности IIа (уровень достоверности С).
Методы молекулярно-генетической диагностики.
• Проведение комплексного генетического анализа на выявление возможных мутаций в генах KCNQ1 KCNH2 и SCN5A (СУИQT 1, 2 и 3-го типов - наиболее распространённые формы заболевания) рекомендовано всем больным, имеющим клинические проявления СУИQT, отягощённый семейный анамнез и удлинение интервала QTc, зарегистрированное на ЭКГ в покое или при проведении провокационных диагностических проб, а также всем пациентам, не имеющим характерных СУИQT симптомов, при регистрации на ЭКГ удлинения интервала QTc >500 мс при отсутствии других возможных причин удлинения интервала QT. [16].
Уровень убедительности I ( уровень достоверности В ).
Комментарий. Методы молекулярно-генетической диагностики имеют большое значение в диагностике СУИQT и определении прогноза больных. При проведении комплексных генетических анализов мутации удаётся обнаружить приблизительно у 75% больных, поэтому отрицательный результат генетического анализа не позволяет полностью исключить диагноз СУИQT.
• Проведение комплексного генетического анализа на выявление возможных мутаций в генах KCNQ1 KCNH2 и SCN5A рекомендовано пациентам, не имеющих характерных СУИQT симптомов, при регистрации на ЭКГ удлинения интервала QTc >480 мс при отсутствии других возможных причин удлинения интервала QT. [16].
Уровень убедительности IIa (уровень достоверности В).
• В случае обнаружения у больного СУИQT генетической мутации проведение скрининга, направленного на выявление этой мутации, рекомендовано всем близким родственникам, даже при отсутствии у них характерных этому заболеванию клинических проявлений и изменений ЭКГ. [16].
Уровень убедительности IIa (уровень достоверности В).
• Методы молекулярно-генетической диагностики также рекомендованы для диагностики синдрома Бругада, однако генетические мутации у больных удаётся обнаружить лишь приблизительно в 30% случаев (ген основной субъединицы натриевых каналов SCN5A), поэтому отрицательный результат генетического анализа не позволяет полностью исключить диагноз синдрома Бругада.
Уровень убедительности I ( уровень достоверности с ).
• В случае обнаружения у больного синдромом Бругада генетической мутации проведение скрининга, направленного на выявление этой мутации, рекомендовано всем близким родственникам, даже при отсутствии у них характерных этому заболеванию изменений ЭКГ. Проведение молекулярно-генетических исследований лицам, имеющим ЭКГ-изменения 2 и 3 типов, при отсутствии у них клинических проявлений синдрома Бругада и отягощённого по ВСС семейного анамнеза в настоящее время не рекомендовано.
Уровень убедительности I ( уровень достоверности с ).
• Анализы на обнаружение мутаций в генах RyR2 и сASQ2 рекомендованы всем больным катехоламинергической полиморфной ЖТ и пациентам, клинические проявления которых с большой вероятностью могут быть обусловлены этим заболеванием, особенно при отягощённом семейном анамнезе. В случае обнаружения у больного патогномоничной генетической мутации проведение скрининга, направленного на выявление этой мутации, рекомендовано всем близким родственникам, даже при отсутствии у них клинических проявлений заболевания.
Уровень убедительности I ( уровень достоверности с ).
• Проведение комплексного молекулярно-генетического скрининга (выявление наиболее частых мутаций в генах KCNH2, KCNQ1 и KCNJ2) может быть рекомендовано больным синдромом укороченного интервала QT.
Уровень убедительности IIb (уровень достоверности с).
Комментарий. Следует учитывать низкую чувствительность методов в диагностике заболевания.
• В случае обнаружения у больного синдромом укороченного интервала QT патогномоничной генетической мутации проведение скрининга, направленного на выявление этой мутации, рекомендовано всем близким родственникам, даже при отсутствии у них клинических проявлений заболевания.
Уровень убедительности I ( уровень достоверности с ).
• Проведение комплексного или целевого генетического скрининга на выявление наиболее частых мутаций в генах DSC2, DSG2, DSP, JUP, PKP2 и TMEM43 рекомендовано всем больным с верифицированным диагнозом АДПЖ. В случае обнаружения у больного патогномоничной генетической мутации проведение скрининга, направленного на выявление этой мутации, рекомендовано всем близким родственникам, даже при отсутствии у них клинических проявлений заболевания.
Уровень убедительности I ( уровень достоверности с ).
• Проведение комплексного или целевого генетического скрининга на выявление наиболее частых мутаций в генах DSC2, DSG2, DSP, JUP, PKP2 и TMEM43 рекомендовано при подозрении на АДПЖ, когда данные клинической картины и результаты других исследований не позволяют однозначно поставить диагноз (наличие только одного большого или только двух малых диагностических критериев).
Уровень убедительности IIа (уровень достоверности С).
• Проведение комплексного или целевого генетического скрининга на выявление наиболее частых мутаций в генах DSC2, DSG2, DSP, JUP, PKP2 и TMEM43 не рекомендовано при низкой вероятности АДПЖ (наличие только одного малого диагностического критерия).
Уровень убедительности I (уровень достоверности с).
Treatment
3,1 Желудочковая экстрасистолия и парасистолия.
• Устранение желудочковой экстрасистолии у пациентов без органического поражения сердца рекомендовано только при наличии выраженных клинических проявлений или в случае, если частая экстрасистолия вызывает дилатацию полостей сердца. [5].Уровень убедительности I ( уровень достоверности с ).
Комментарий. Устранение желудочковой экстрасистолии или желудочковой парасистолии редко выступает в качестве самостоятельной клинической задачи. Такая задача может возникать в случаях очень частой ЖЭ, устойчиво регистрирующейся на протяжении длительного времени (месяцы, годы). Как указывалось, выше, при желудочковой экстрасистолии резко нарушается последовательность электрического возбуждения желудочков, что влечет за собой соответствующие нарушения нормальной последовательности сокращения сердца. Это явление получило название механической диссинхронии. Чем больше продолжительность желудочкового эктопического комплекса QRS на ЭКГ, тем больше степень выраженности механической диссинхронии, и чем больше таких «диссинхроничных» ударов сердца, тем выше вероятность развития, со временем, вторичной дилатации сердца со снижением показателей его насосной работы и развитием сердечной недостаточности. Такая последовательность развития событий под действием частой ЖЭ может нередко наблюдаться в том числе и у лиц, не имеющих изначально клинических признаков органического заболевания сердца. Для количественной оценки ЖЭ применяется показатель, обозначаемый как «бремя ЖЭ». Оно определяется процентом желудочковых эктопических сокращений от общего количества ударов сердца, зарегистрированного за сутки с помощью ХМ ЭКГ. Считается, что вероятность развития вторичной дилатации полостей сердца довольно высока, если бремя ЖЭ превышает 25%, особенно в тех случаях, когда продолжительность эктопических комплексов QRS составляет 150 мс и более. Устранение ЖЭ в таких случаях способно предупредить это явление.
• Не рекомендовано Назначение антиаритмических препаратов или проведение РЧА больным с частой ЖЭ, не имеющим клинических проявлений и признаков вторичной дилатации полостей сердца.[5].
Уровень убедительности III (уровень достоверности с).
3,1,1 Консервативное лечение.
• В качестве эффективных средств медикаментозного противоаритмического лечения у больных ЖЭ без структурного заболевания сердца рекомендованы препараты I (прежде всего IC) класса и препараты III класса, за исключением дронедарона ( см приложение Г2).[5].Уровень убедительности I ( уровень достоверности с ).
Комментарий. Учитывая высокий риск побочных эффектов при длительном использовании амиодарона**, назначение данного препарата должно осуществляться только при неэффективности других антиаритмических препаратов в случае, если ожидаемая польза от подавления ЖЭ превышает риск побочных эффектов лечения.
• Применение антиаритмических препаратов IA и IC классов у больных со структурным заболеванием сердца не рекомендовано (противопоказано). [1, 4-5].
Уровень убедительности III (уровень достоверности A).
Комментарии. После перенесенного инфаркта миокарда значительно возрастает вероятность аритмогенного действия препаратов I класса, что является основной причиной существенного возрастания риска внезапной аритмической смерти, при их использовании у данной категории больных. По этой причине у больных, переживших инфаркт миокарда с зарегистрированной на ЭКГ ЖЭ и другими формами сердечных аритмий, препараты I класса должны быть исключены из клинического применения. Такие же ограничения распространяются и на пациентов с другими формами сердечной патологии, приводящими к дилатации полости и снижению фракции выброса левого желудочка (по данным ЭХО КГ), к гипертрофии миокарда левого желудочка (1,5 см и более, по данным ЭХО КГ), а также к проявлениям хронической сердечной недостаточности. Наиболее опасно применение у этих категорий больных препаратов IC класса. Вот почему у больных со структурным заболеванием сердца рекомендовано применение только антиаритмических препаратов III класса (амиодарона** и соталола**), при этом у пациентов с сердечной недостаточностью, единственным рекомендованным к применению препаратом (помимо β-адреноблокаторов) является амиодарон**.
• У пациентов с ИБС в целях подавления желудочковой экстрасистолии рекомендовано использование β-адреноблокаторов, соталола** или амиодарона**.
Уровень убедительности I ( уровень достоверности с ).
• Пациентам, перенесшим инфаркт миокарда, имеющим сниженную ФВЛЖ и частую ЖЭ, в целях контроля симптомов может быть рекомендовано назначение амиодарона**, но только в случае выраженных клинических проявлений ЖЭ, поскольку постоянный приём препарата сопровождается высоким риском развития побочных эффектов. [5].
Уровень убедительности IIb (уровень достоверности в).
Комментарий. Следует учитывать, что подавление ЖЭ при этом не оказывает влияния на прогноз заболевания, а только лишь улучшает качество жизни.
3,1,2 Хирургическое лечение.
• Радиочастотная катетерная аблация (РЧА) источника эктопической активности при частой ЖЭ и/или ЖТ из выводного тракта правого желудочка (характерные электрокардиографические проявления) рекомендована в случае, если нарушения ритма сердца сопровождаются клиническими проявлениями и/или вторичной дилатацией полостей сердца, при неэффективности медикакментозной терапии препаратами IC класса или как альтернативный метод лечения. [5].Уровень убедительности I (уровень достоверности в).
Комментарии. Монотопная ЖЭ может быть устранена посредством РЧА источника эктопической активности. Следует подчеркнуть, что данное вмешательством является эндоваскулярным вмешательством, не требующим хирургического доступа и (в подавляющем большинстве случаев) анестезиологического пособия.
• РЧА источника эктопической активности при частой ЖЭ и/или ЖТ другой локализации рекомендовано в случае неэффективности антиаритмической терапии препаратами IC класса (имеется опыт приёма хотя бы одного препарата в адекватной терапевтической дозе) или в случае, если пациент желает избежать необходимости постоянного приёма лекарственных препаратов. [5].
Уровень убедительности IIa (уровень достоверности в).
• Проведение РЧА при политопной ЖЭ не рекомендовано.[5].
Уровень убедительности III (уровень достоверности с).
3,2 Желудочковая тахикардия.
• При ФЖ или ЖТ без пульса ключевым элементом реанимации ( , однозначно рекомендована) является экстренная электрическая дефибрилляция с применением энергии разряда 150-360 Дж.[5].Уровень убедительности I ( уровень достоверности с ).
• При неэффективности трёх разрядов перед применением следующих разрядов рекомендуется внутривенное болюсное введение амиодарона** в дозе 300 мг. Менее эффективно в этих случаях применение лидокаина** (100-200 мг внутривенно). Введение препаратов производится на фоне непрерывного наружного массажа сердца.[5].
Уровень убедительности I ( уровень достоверности с ).
Комментарий. В случае восстановления синусового ритма, при необходимости может быть начата постоянная внутривенная инфузия препаратов.
3,2,1 Консервативное лечение.
• У больных с устойчивыми пароксизмами ЖТ без серьезных нарушений гемодинамики при отсутствии структурной патологии сердца (например, идиопатическая тахикардия из выводного тракта правого желудочка, фасцикулярная левожелудочковая тахикардия ), может быть рекомендовано внутривенное введение прокаинамида**, лидокаина**, β-адреноблокаторов, верапамила**, трифосаденина или амиодарона**.[5].Уровень убедительности IIb (уровень достоверности с).
Комментарии. Выбор антиаритмического препарата должен осуществляться с учётом характерных для разных форм ЖТ изменений ЭКГ. Введение антиаритмических препаратов должно осуществляться только в условиях блока интенсивной терапии в связи с риском побочных эффектов (например, артериальной гипотензии, коллапса). Возможной альтернативой является проведение электрической кардиоверсии под коротким наркозом.
• При пароксизмальной мономорфной ЖТ наиболее эффективными являются антиаритмические препарата I и III классов, и как средства купирования пароксизмов при внутривенном применении, и как средства предупреждения их повторного развития, при регулярном длительном приеме внутрь ( см табл. 4). При этом следует строго соблюдать ограничения по безопасности применения препаратов I класса, обусловленные высоким риском их аритмогенного действия у больных с тяжелым органическим поражением сердца. Препараты I класса должны быть исключены из клинического применения у больных ИБС, в том числе переживших инфаркт миокарда, а также у пациентов с другими формами сердечной патологии, приводящими к дилатации полости и снижению фракции выброса левого желудочка (<40% по данным ЭХО КГ), к гипертрофии миокарда левого желудочка (1,5 см и более, по данным ЭХО КГ), а также к проявлениям хронической сердечной недостаточности. Наиболее опасно применение у этих категорий больных препаратов IC класса.
• Из препаратов IА класса парентерально используется только прокаинамид**. После предварительного разведения в 20 мл физиологического раствора его можно вводить внутривенно струйно в дозе 0,5-1,0 г лишь при отсутствии представленных выше ограничений по безопасности применения. Из-за риска развития гипотонии препарат вводится медленно (в течение 10-15-20 минут) под постоянным контролем уровня АД.
• Более эффективно и безопасно внутривенное струйное введение лидокаина** в дозе 1-2 мг/кг в течение 3-5 минут с последующей, при необходимости, поддерживающей инфузией со скоростью 1-4 мг/мин.
• Внутривенное введение амиодарона** в дозе 5 мг/кг в течение 15-20 мин как правило оказывается более эффективным. При необходимости продолжения введения препарата может быть начата постоянная инфузия в суточной дозе 1,2-1,8 г (максимальная суточная доза 2,2 г).
• При фасцикулярной левожелудочковой тахикардии и НПЖТ внутривенное введение верапамила**, а также трифосаденина (АТФ) являются высоко эффективными способами купирования. При этих формах тахикардии для предупреждения рецидивов эффективен регулярный длительный прием внутрь верапамила, а также средств, относящихся к IC классу.
• Внутривенное введение антиаритмических препаратов проводится под постоянным контролем уровня артериального давления и ЭКГ. Развитие предсердно-желудочковой блокады II-III степени, расширение синусовых комплексов QRS >160 мс и удлинение интервала QT >500 мс, также в синусовых комплексах, требует прерывания введения.
• В целях профилактики рецидивов мономорфной ЖТ, ТЖ и ФЖ, в том числе после проведенной имплантации кардиовертора-дефибриллятора ( см ниже), рекомендуется назначение на длительный постоянный прием соталола**, амиодарона** ( см табл. 4), а также комбинации амиодарона** и β-блокаторов.[4-6].
Уровень убедительности IIa (уровень достоверности с).
• рекомендуется больным со сниженной фракцией выброса левого желудочка, проявлениями хронической сердечной недостаточности, а также при наличии признаков почечной недостаточности, препаратом выбора является амиодарон**. [4-6].
Уровень убедительности IIa (уровень достоверности с).
• соталол** не рекомендован больным сердечной недостаточностью со сниженной фракцией выброса левого желудочка. [4-6].
Уровень убедительности III (уровень достоверности A).
• Рекомендуется назначение амиодарона** уже после первого рецидива устойчивой ЖТ у пациентов с ИБС и ИКД. [5].
Уровень убедительности IIa (уровень достоверности в).
• Применение антиаритмических препаратов IС и III классов рекомендовано для предупреждения пароксизмов ЖТ у пациентов без структурного заболевания сердца.[4-6].
Уровень убедительности IIa (уровень достоверности с).
Комментарий. Поскольку и фасцикулярная левожелудочковая тахикардия и НПЖТ возникают, как правило, у лиц, не имеющих признаков органического заболевания сердца, назначение им препаратов IC класса безопасно.
• Профилактический приём верапамила рекомендуется для предупреждения пароксизмов НПЖТ и фасцикулярной левожелудочковой тахикардии.[4-6].
Уровень убедительности IIa (уровень достоверности с).
• Лечение больных с желудочковой тахикардией типа TdP рекомендуется начинать с выявления и устранения причин удлинения интервала QT, прежде всего с отмены любых лекарственных средств, способных удлинять интервал QT, если таковые применяются.[4-6].
Уровень убедительности I ( уровень достоверности с ).
Комментарий. Выявить и устранить причины удлинения интервала QT удается, как показывает практика, в подавляющем большинстве случаев, но почти никогда это не дает быстрого результата.
• Внутривенное введение магния сульфата ** рекомендовано при возникновении полиморфной желудочковой тахикардии типа пируэт.[4-6].
Уровень убедительности I ( уровень достоверности с ).
Комментарий. Нередко оказывается эффективным, в том числе и у пациентов с исходно нормальным уровнем магния в крови.
• При отсутствии эффекта от введения магния сульфата ** рекомендована временная электрокардиостимуляция с частотой 100 и больше в минуту.[4-6].
Уровень убедительности I ( уровень достоверности с ).
Комментарий. Навязывание, таким образом, сердцу высокой частоты сокращений приводит к укорочению интервала QT и способствует предотвращению рецидивов TdP. Продолжительность электрокардиостимуляции определяется временем, необходимым для устранения причины удлинения интервала QT, например, временем экскреции того или иного препарата, явившегося причиной удлинения интервала QT.
• Если причиной удлинения интервала QT с развитием TdP является брадикардия, например, полная АВ-блокада, электрокардиостимуляция должна быть первым и основным этапом лечения, а при наличии соответствующих возможностей, сразу же рекомендуется постоянная электрокардиостимуляция с имплантацией искусственного водителя ритма сердца. [4-6].
Уровень убедительности I ( уровень достоверности с ).
• Не рекомендовано применение антиаритмических препаратов (особенно препаратов III класса) с целью купирования тахикардии типа TdP.[4-6].
Уровень убедительности III (уровень достоверности с).
3,2,2 Хирургическое лечение.
Уровень убедительности I (уровень достоверности A).• РЧА рекомендована для устранения рецидивов пароксизмальной ЖТ из выводного тракта правого желудочка, фасцикулярной левожелудочковой тахикардии и НПЖТ. [5].
Уровень убедительности I (уровень достоверности в).
Комментарий. Как было представлено выше, каждая из этих форм тахикардии характеризуется наличием отчетливого, топографически ограниченного анатомического субстрата - заднее-нижняя ветвь левой ножки пучка Гиса - при фасцикулярной левожелудочковой тахикардии; выносящий тракт правого желудочка - при НПЖТ. В силу этого, при данных формах тахикардии, в отличие от других ЖТ, высока эффективность применения радиочастотной катетерной аблации, как способа радикального излечения, не требующего последующей противоаритмической терапии.
• РЧА для устранения рецидивов идиопатических ЖТ ( , у пациентов без структурного заболевания сердца) другой локализации рекомендовано в случае неэффективности антиаритмической терапии препаратами IC класса (имеется опыт приёма хотя бы одного препарата в адекватной терапевтической дозе) или в случае, если пациент желает избежать необходимости постоянного приёма лекарственных препаратов. [5].
Уровень убедительности IIa (уровень достоверности в).
• РЧА ножки пучка Гиса рекомендована для устранения рецидивов фасцикулярных ЖТ, обусловленных циркуляцией импульса в системе Гиса-Пуркинье между правой и левой ножками пучка Гиса в качестве меры первого ряда. [5].
Уровень убедительности I ( уровень достоверности с ).
Комментарий. Чаще всего выполняют РЧА правой ножки пучка Гиса, поскольку техника процедуры проще. Так как данная форма ЖТ обычно отмечается у пациентов со структурным заболеванием сердца, помимо РЧА этим больным рекомендована имплантация ИКД.
• Экстренная катетерная аблация рекомендована пациентам с непрерывной ЖТ или электрического шторма на фоне рубцовых изменений миокарда. [5].
Уровень убедительности I (уровень достоверности в).
Комментарий. Вмешательство должно выполняться в условиях специализированного стационара, имеющего необходимое оснащение и опыт проведения таких процедур.
• Катетерная аблация рекомендована пациентам с ишемической болезнью сердца и частыми разрядами ИКД в связи с рецидивами ЖТ. [5].
Уровень убедительности I (уровень достоверности в).
• Выполнение катетерной аблации рекомендуется уже после первого рецидива устойчивой ЖТ у пациентов с ИБС и ИКД. [5].
Класс рекомендации IIa, уровень доказательности в.
3,3 Синдром удлиненного интервала QT.
• Рекомендуется всех пациентов информировать о своём заболевании, в том числе его наследственном характере и риске заболевания у детей, и получить общие рекомендации, направленные на уменьшение риска развития TdP и ВСС. [11].Уровень убедительности I (уровень достоверности в).
• Рекомендовано полное исключение приёма лекарственных препаратов, вызывающих увеличение продолжительности интервала QT. [11].
Уровень убедительности I (уровень достоверности в).
TEGb Комментарий: По мере накопления клинической информации и внедрения в практику новых лекарственных препаратов данный перечень претерпевает изменения. Постоянно обновляемая информация о лекарственных препаратах, способных увеличивать продолжительность интервала QT, представлена на сайте http://www.azcert.org.
• Рекомендуется избегать ситуаций, способных вызывать электролитные нарушения (неконтролируемый приём мочегонных и гормональных препаратов, голодание, обезвоживание, пищевые отравления, сопровождающиеся профузной рвотой или диареей ). [11].
Уровень убедительности I (уровень достоверности в).
• Рекомендуется по возможности избегать пусковых факторов, которые могут провоцировать индукцию TdP (спортивные нагрузки, особенно плавание; эмоциональный стресс, громкие звуки и пр. [11].
Уровень убедительности I (уровень достоверности в).
3,3,1 Консервативное лечение.
• Медикаментозная терапия является основой лечения наследственного СУИQT. Постоянный приём β-адреноблокаторов рекомендован всем больным наследственным СУИQT, включая подтверждённых бессимптомных носителей мутации, даже при отсутствии у них на ЭКГ удлинения интервалов QT/QTc (за исключением абсолютных противопоказаний к приёму препаратов, например, тяжёлого течения бронхиальной астмы). [11].Уровень убедительности I (уровень достоверности в).
Комментарий. В настоящее время отсутствуют данные, указывающие на более высокую эффективность какого-либо из β-адреноблокаторов в профилактике рецидивов TdP у больных наследственным СУИQT. Выбор лекарственного препарата, подбор его дозы и определение режима приёма осуществляются индивидуально. В целях уменьшения риска побочных эффектов препарата и для удобства больных предпочтение следует отдавать кардиоселективным β-адреноблокаторам с большой длительностью действия. Пациентов следует обязательно информировать о том, что длительное отсутствие рецидивов TdP на фоне лечения ни в коем случае не должно быть расценено в качестве повода прекратить приём препарата. В случае необходимости прекращение приёма β-адреноблокаторов должно быть осуществлено постепенно, предпочтительно под контролем медицинского персонала, поскольку резкое прекращение лечения может сопровождаться «синдромом отмены», на фоне которого риск индукции TdP особенно высок [67].
• Антиаритмические препараты I класса (блокаторы натриевых каналов, предпочтительно IВ класса: мексилетин [в России в настоящее время не зарегистрирован], фенитоин**) могут быть рекомендованы в качестве средств «второй линии» при частых рецидивах TdP у больных врождённым СУИQT с имплантированным кардиовертером-дефибриллятором (ИКД), при недостаточной эффективности β-адреноблокаторов или невозможности их приёма в связи с абсолютными противопоказаниями или тяжёлыми побочными эффектами лечения.
Уровень убедительности IIb (уровень достоверности с).
Комментарий. В настоящее время опыт эффективного применения этих препаратов ограничен лишь больными СУИQT3. В качестве критерия, указывающего на потенциальную эффективность планируемого долгосрочного лечения предложено уменьшение длительности интервала QTc на 40 мс и более после перорального приёма антиаритмического препарата I класса.
3,3,2 Хирургическое лечение.
• Рекомендуется имплантация кардиовертера-дефибриллятора больным СУИQT, пережившим остановку сердца, а также пациентам, у которых приступы TdP продолжают рецидивировать, несмотря на систематический приём β-адреноблокаторов. [11].Уровень убедительности I (уровень достоверности в).
Комментарий. Имплантация кардиовертера-дефибриллятора не избавляет больного наследственным СУИQT от необходим приёма β-адреноблокаторов и ни в коем случае не должна рассматриваться в качестве альтернативы медикаментозной терапии.
• Имплантация кардиовертера-дефибриллятора для профилактики ВСС без предшествующей оценки эффективности лечения β-адреноблокаторами рекомендовано больным СУИQT, относящимся к категории высокого риска. [11, 16].
Уровень убедительности IIa (уровень достоверности в).
Комментарий: На неблагоприятный прогноз болезни указывает выраженное увеличение длительности QTc >500 мс (особенно высокий риск у больных с увеличением длительности QTc >600 мс), сохраняющаяся на фоне приёма β-адреноблокаторов альтернация зубцов Т на ЭКГ, ранние клинические проявления заболевания - приступы потери сознания, пароксизмы TdP в возрасте до 7 лет, а также результаты молекулярно-генетических исследований (подтверждение наиболее злокачественных форм заболевания - синдрома Джервелла и Ланге-Нильсена или синдрома Тимоти -, наличие двух и более генетических мутаций или обнаружение генетических мутаций, сопряжённых с более высоким риском TdP и ВСС). ВСС родственника больного наследственным СУИQT при отсутствии других факторов риска не является показанием к имплантации кардиовертера-дефибриллятора. В этих ситуациях рекомендцется назначение β-адреноблокаторов и имплантация ИКД.
• Имплантация кардиовертера-дефибриллятора для профилактики ВСС без предшествующей оценки эффективности лечения β-адреноблокаторами не рекомендована больным СУИQT (за исключением пациентов, относящихся к категории высокого риска). [11, 16].
Уровень убедительности III (уровень достоверности в).
• Левосторонняя шейная симпатическая денервация целесообразна в случаях невозможности назначения β-адреноблокаторов или недостаточной эффективности медикаментозной терапии, а также при наличии абсолютных/относительных противопоказаний к имплантации кардиовертера-дефибриллятора или отказе пациента от инвазивного вмешательства.
Уровень убедительности IIa (уровень достоверности с).
Комментарий. Процедуру левосторонней шейной симпатической денервации осуществляют левым надключичным доступом. В опытных медицинских центрах применяют минимально инвазивные методики.
3,4 Синдром Бругада.
• Рекомендуется подробно информировать всех больных об особенностях их заболевания.[4-6].Уровень убедительности I ( уровень достоверности с ).
Комментарий. Все больные синдромом Бругада должны получить подробную информацию о своём заболевании, его наследственном характере, и комплекс общих рекомендаций, направленных на минимизацию риска ВСС.
• Поскольку лихорадочные состояния способствуют возникновению опасных для жизни нарушений ритма сердца, всем больным синдромом Бругада рекомендовано незамедлительное применение жаропонижающих средств при повышении температуры. Также рекомендовано избегать экзогенной гипертермии (например, посещения парных).
Уровень убедительности I ( уровень достоверности с ).
• Пациентам с синдромом Бругада рекомендуется избегать приёма потенциально аритмогенных лекарственных препаратов. Постоянно обновляемый перечень этих препаратов также представлен на сайте http://brugadadrugs.org [23].[4-6].
Уровень убедительности I ( уровень достоверности с ).
3,4,1 Консервативное лечение.
• Систематический приём хинидина (препарат в России не зарегистрирован) рекомендован пациентам с ИКД при частых рецидивах желудочковых аритмий. Применение этого препарата целесообразно и для подавления наджелудочковых аритмий, если таковые имеются.[4-6].Уровень убедительности IIa (уровень достоверности с).
Комментарий: В настоящее время медикаментозное лечение при синдроме Бругада может быть использовано только в качестве дополнительной меры. Лекарственные препараты, подавляющие ток калиевый ток Ito или активирующие токи INa и ICa потенциально могут быть эффективны у больных синдромом Бругада. Хинидин должен назначаться в тех случаях, когда имеются противопоказания к имплантации кардиовертера-дефибриллятора или, когда больные категорически отказываются от имплантации этого устройства.
• Применение изопротеренола (препарат в России не зарегистрирован) рекомендуется для купирования и предупреждения непрерывно рецидивирующих желудочковых аритмий, приводящих к частому срабатыванию ИКД («электрическому шторму») у больных синдромом Бругада. [24].
Уровень убедительности IIa (уровень достоверности с).
3,4,2 Хирургическое лечение.
• Имплантация кардиовертера-дефибриллятора рекомендована пациентам, пережившим ВСС и больным, имеющим документированные устойчивые пароксизмы ЖТ или эпизоды ФЖ.[4-6].Уровень убедительности I ( уровень достоверности с ).
Комментарий. Имплантация кардиовертера-дефибриллятора является единственным методом, позволяющим статистически достоверно уменьшить риск ВСС больных синдромом Бругада.
• Имплантация ИКД рекомендовано пациентам с характерными для синдрома Бругада изменениями ЭКГ в случае клинических проявлений, наиболее вероятно, обусловленных возникновением опасных для жизни аритмий.[4-6].
Уровень убедительности IIa (уровень достоверности с).
• Имплантация кардиовертера-дефибриллятора не рекомендована пациентам с ЭКГ-феноменом Бругада, не имеющим клинических проявлений заболевания.[4-6].
Уровень убедительности III (уровень достоверности с).
Комментарий. В этом случае для оценки риска ВСС и возможного выявления бессимптомных желудочковых нарушений ритма сердца целесообразно проведение комплекса инструментальных исследований, включающего внутрисердечное электрофизиологическое исследование (ЭФИ). Невозможность индукции желудочковых аритмий в ходе этого исследования указывает на низкий риск развития ВСС.
• Имплантация ИКД может быть рекомендована больным синдромом Бругада, у которых в ходе внутрисердечного ЭФИ удается индуцировать устойчивую ЖТ или ФЖ.[4-6].
Уровень убедительности IIb (уровень достоверности с).
3,5 Катехоламинергическая полиморфная желудочковая тахикардия.
• Больные катехоламинергической полиморфной ЖТ должны быть информированы об опасности и наследственном характере своего заболевания. Все пациенты должны получить общие рекомендации прекратить занятия профессиональным спортом и избегать провоцирующих желудочковые аритмии физических нагрузок и эмоционального стресса.[4-6].Уровень убедительности I ( уровень достоверности с ).
3,5,1 Консервативное лечение.
• Медикаментозная терапия является основой лечения данного заболевания. Всем больным рекомендован постоянный приём β-адреноблокаторов, не обладающих внутренней симпатомиметической активностью.[4-6].Уровень убедительности I ( уровень достоверности с ).
Комментарий. Для предупреждения рецидивов аритмии обычно требуются большие дозы препаратов, подбор которых должен осуществляться индивидуально. Для оценки эффективности проводимого лечения целесообразны повторные провокационные пробы с физической нагрузкой. На эффективность проводимого лечения указывает невозможность повторной индукции пароксизмов ЖТ и других проявлений желудочковой эктопической активности высоких градаций (парной ЖЭ, желудочковой бигеминии и «пробежек» ЖТ).
Недостаточная приверженность пациентов к терапии является основной причиной рецидивов пароксизмов ЖТ. Все больные должны быть информированы об опасности резкого прекращения лечения β-адреноблокаторами в связи с высоким риском возникновения опасных для жизни аритмий на фоне синдрома отмены.
• Верапамил** и флекаинид (в России не зарегистрирован) рекомендованы для профилактики рецидивов ЖТ при недостаточной эффективности β-адреноблокаторов.[4-6].
Уровень убедительности IIa (уровень достоверности с).
Комментарий. Сведения об эффективности препаратов очень ограничены, их назначение требует большой осторожности.
3,5,2 Хирургическое лечение.
• Имплантация кардиовертера-дефибриллятора рекомендована больным, у которых пароксизмы ЖТ продолжают рецидивировать на фоне лечения β-адреноблокаторами, а также больным катехоламинергической ЖТ, пережившим остановку сердца (ВСС).[4-6].Уровень убедительности I (уровень достоверности с).
Комментарий. В случае если больной пережил остановку сердца до назначения ему β-адреноблокаторов, учитывая злокачественное течение заболевания, рекомендована имплантация кардиовертера-дефибриллятора и назначение медикаментозного лечения. Все больные катехоламинергической полиморфной ЖТ с ИКД должны получать медикаментозную терапию в полном объёме. Следует отметить, что болезненные разряды ИКД провоцируют выброс катехоламинов, что может способствовать непрерывному рецидивированию ЖТ, поэтому целесообразно программирование более длительных временных интервалов между наносимыми устройством разрядами.
• Процедура левосторонней шейной симпатической денервации может быть рекомендована при недостаточной эффективности β-адреноблокаторов или при наличии противопоказаний к их применению.[4-6].
Уровень убедительности IIb (уровень достоверности с).
Комментарий. Отдалённые результаты применения этого метода лечения при данном заболевании пока не получены.
3,6 Синдром укороченного интервала QT.
3,6,1 Консервативное лечение.
• В случае частых рецидивов ЖТ и ФЖ у больных с ИКД целесообразно применение препаратов, удлиняющих интервал QT - хинидина (в России не зарегистрирован) и соталола**.[4-6].Уровень убедительности IIa (уровень достоверности с).
Комментарий. Сведения об эффективности амиодарона** отсутствуют.
3,6,2 Хирургическое лечение.
• В целях профилактики ВСС рекомендована имплантация кардиовертера-дефибриллятора всем больным, пережившим остановку сердца, а также пациентам с документированными пароксизмами ЖТ.[4-6].Уровень убедительности I ( уровень достоверности с ).
Комментарий. Имплантация кардиовертера-дефибриллятора может быть целесообразна и при семейном анамнезе, отягощённом случаями ВСС. При выборе устройства предпочтение следует отдавать аппаратам с дополнительными алгоритмами дискриминации во избежание т.н. «немотивированных» разрядов ИКД вследствие ошибочного восприятия им высокоамплитудной Т-волны как волны R.
3,7 Аритмогенная дисплазия-кардиомиопатия правого желудочка.
• Рекомендуется лечение АДПЖ включающее профилактику ВСС ( см приложение Г3) и лечение сердечной недостаточности, осуществляемое по общим для этого заболевания принципам.[4-6].Уровень убедительности I ( уровень достоверности с ).
• Рекомендуется хорошо информировать всех больных АДПЖ о заболевании, его наследственном характере, прогрессирующем течении, необходимости систематического наблюдения у кардиолога, а также соблюдения комплекса общих мероприятий, направленных на минимизацию риска ВСС.[4-6].
Уровень убедительности I ( уровень достоверности с ).
• Больным АДПЖ и бессимптомным носителям генетических мутаций рекомендуется ограничивать физические нагрузки.[4-6].
Уровень убедительности I ( уровень достоверности с ).
Комментарий. Спортивные нагрузки могут способствовать возникновению опасных для жизни аритмий, кроме того они повышают механическую нагрузку на миокард желудочков, что может ускорять темпы прогрессирования заболевания, вот почему профессиональные занятия спортом противопоказаны как больным АДПЖ, так и носителям генетических мутаций, не имеющим клинических проявлений [37].
3,7.
1 Консервативное лечение.• Поскольку АДПЖ - структурное заболевание сердца, назначение антиаритмических препаратов, особенно I класса, может существенно увеличивать риск ВСС. В настоящее время к применению при АДПЖ рекомендованы только β-адреноблокаторы, амиодарон** и соталол**.[4-6].
Уровень убедительности I ( уровень достоверности с ).
Комментарий. Приём β-адреноблокаторов для первичной и вторичной профилактики ВСС показан всем больным с подтверждённым диагнозом АДПЖ.
• Назначение соталола** или амиодарона** рекомендуется при частых рецидивах ЖТ у больных АДПЖ с имплантированными кардиовертерами-дефибрилляторами, получающих β -блокаторы.[4-6].
Уровень убедительности IIa (уровень достоверности с).
Комментарий. Выбор антиаритмического препарата должен осуществляться индивидуально, с учётом отрицательного инотропного эффекта соталола** и большой вероятности развития несердечных побочных эффектов при длительном лечении амиодароном**. Последнее особенно важно при необходимости назначения препарата молодым больным [40-41].
3,7,2 Хирургическое лечение.
• Имплантация кардиовертера-дефибриллятора рекомендована всем больным АДПЖ с документированными пароксизмами ЖТ и всем больным АДПЖ, пережившим ВСС, в связи с высокой вероятностью рецидивов опасных для жизни аритмий.[38-39].Уровень убедительности I ( уровень достоверности с ).
Комментарий. Имплантация кардиовертера-дефибриллятора является единственным эффективным методом профилактики ВСС у больных АДПЖ.
• Имплантация кардиовертера-дефибриллятора рекомендуется всем больным с подтверждённым диагнозом АДПЖ при возникновении у них синкопальных состояний, в отсутствии других явных причин развития приступов потери сознания (поскольку наиболее вероятная их причина - гемодинамически не стабильная ЖТ или ФЖ) и при индукции ЖТ во время внутрисердечного ЭФИ.[38-39].
Уровень убедительности IIa (уровень достоверности с).
• Имплантация кардиовертера-дефибриллятора с целью первичной профилактики ВСС рекомендована больным с выраженным нарушением систолической функции правого желудочка, пациентам с вовлечением в патологический процесс миокарда обоих желудочков, а также при наличии спонтанных неустойчивых пробежек ЖТ [38-39].
Уровень убедительности IIb (уровень достоверности с).
• Применение РЧА при АДПЖ рекомендуется больным с имплантированными кардиовертерами-дефибрилляторами и рецидивирующими пароксизмами ЖТ, при неэффективности у них медикаментозной антиаритмческой терапии.[38-39].
Уровень убедительности IIa (уровень достоверности с).
Комментарий. В ряде случаев у больных АДПЖ оказывается эффективной РЧА эпикардиальным доступом, что может быть связано с большей глубиной наносимых воздействий и большей толщиной формирующегося рубца, а также с тем, что у больных АДПЖ циклы re-entry чаще локализованы в субэпикардиальных слоях миокарда.
Инвазивные вмешательства у больных АДПЖ сопряжены с большими техническими трудностями, обусловленными необходимостью идентификации аритмогенной зоны, гемодинамической нестабильностью индуцируемых ЖТ и риском перфорации поражённой стенки правого желудочка в ходе процедуры. Они должны выполняться в специализированных медицинских центрах, персонал которых имеет достаточный опыт проведения таких вмешательств [42].
Rehabilitation and outpatient treatment
В настоящее время программы реабилитации как таковой для больных желудочковыми нарушениями ритма сердца не существует. Реабилитационные мероприятия должны осуществляться в соответствии с основным заболеванием, являющимся причиной аритмии, если таковое имеется.
Prevention
• β-блокаторы рекомендуются для лечения всех категорий больных, имеющих повышенный риск внезапной смерти и нуждающихся в ее первичной или вторичной профилактике. [8].
Уровень убедительности I (уровень достоверности A).
Комментарий. β-блокаторы входят в стандарты лечения больных, переживших инфаркт миокарда и больных с хронической сердечной недостаточностью, как препараты, увеличивающие продолжительность жизни этих категорий пациентов. Доказано, что ключевую роль в достижении этих результатов играет существенное и достоверное снижение частоты случаев ВСС.
• С целью вторичной профилактики ВСС применение ИКД рекомендовано:[8].
• больным, пережившим остановку кровообращения, вызванную ФЖ желудочков или ЖТ, после исключения других причин или обратимых факторов;
• больным с органическим поражением сердца и устойчивыми пароксизмами ЖТ, независимо от тяжести их гемодинамических проявлений;
• больным с обмороками неясного происхождения, если при проведении ЭФИ достигается индукция ФЖ или ЖТ с острыми, тяжелыми нарушениями гемодинамики.
Уровень убедительности I (уровень достоверности A).
Комментарий. Больные, пережившие успешную реанимацию по поводу ФЖ, а также пациенты с устойчивыми пароксизмами ЖТ, протекающими с нарушениями гемодинамики (при условии, что эти нарушения ритма сердца проявились вне острой фазы инфаркта миокарда или возникли на фоне другой тяжелой хронической патологии сердца) нуждаются в применении автоматических имплантируемых кардиовертеров-дефибрилляторов (ИКД), как средств вторичной профилактики ВСС, обеспечивающих у этих категорий больных достоверное снижение летальности, за счет снижения частоты случаев ВСС.
• Назначение амиодарона** в комбинации с β-блокаторами или соталола** рекомендовано, когда применение β-блокаторов не оказывает влияния на течение рецидивирующих пароксизмов ЖТ или ФЖ после выполненной имплантации ИКД. [8].
Уровень убедительности I (уровень достоверности A).
Комментарий. Применение соталола** в этих целях менее эффективно, чем амиодарона**.
• Назначение амиодарона** рекомендовано при наличии пароксизмов ЖТ у больных с признаками дисфункции левого желудочка, если они отказываются от имплантации ИКД или эта операция не может быть выполнена по каким-либо другим причинам. [8].
Уровень убедительности I (уровень достоверности A).
Комментарий. В решении вопросов вторичной профилактика внезапной смерти у больных со злокачественными желудочковыми аритмиями, амиодарон** и его комбинированное применение с β-блокаторами являются единственной лекарственной альтернативой ИКД, способной не только предупреждать рецидивы ЖТ, но и увеличивать продолжительность жизни этих пациентов.
• Применение ИКД в целях первичной профилактики ВСС рекомендовано больным с фракцией выброса левого желудочка (ФВЛЖ) <35% после инфаркта миокарда (не менее чем через 40 дней), при наличии недостаточности кровообращения II-III функционального класса (ФК), по классификации NYHA, или с ФВЛЖ <30%, в те же сроки после инфаркта миокарда, при наличии недостаточности кровообращения I ФК по NYHA. [4-5].
Уровень убедительности I (уровень достоверности A).
• Применение ИКД в целях первичной профилактики ВСС рекомендовано больным с ФВЛЖ <35% на фоне дилатационной кардиомиопатии, при наличии недостаточности кровообращения II-III ФК по NYHA;[5].
Уровень убедительности I (уровень достоверности в).
• Применение ИКД в целях первичной профилактики ВСС рекомендовано больным с ФВЛЖ <40% после инфаркта миокарда, с эпизодами неустойчивой ЖТ, если при проведении ЭФИ достигается индукция ФЖ или устойчивой ЖТ.[10].
Уровень убедительности IIa (уровень достоверности в).
Комментарий. У больных, нуждающихся в первичной профилактике ВСС, ее риск, как и при вторичной профилактике, может быть существенно снижен назначением β-адреноблокаторов, а также амиодарона**. Более эффективно комбинированное применение амиодарона** и β-адреноблокаторов.
• Рекомендовано назначение оптимальной медикаментозной терапии всем пациентам, которым операция имплантации кардиовертера-дефибриллятора планируется или уже была проведена. [9-10].
Уровень убедительности I (уровень достоверности A).
Комментарий. Обязательным условием применения ИКД с целью, как первичной, так и вторичной профилактики ВСС, повышающим эффективность такой профилактики, является оптимальная медикаментозная терапия, способная обеспечить устойчивое клиническое состояние больных. Эта терапия должна проводиться в соответствии с требованиями по лечению сердечно-сосудистых заболеваний, представленными в соответствующих рекомендациях.
• Пациентам с частой ЖЭ, независимо от наличия или отсутствия клинических проявлений, рекомендуется регулярное наблюдение у кардиолога и прохождение эхокардиографического исследования в целях своевременного выявления возможно вызванной частой ЖЭ дилатации полостей сердца.
Уровень убедительности I (уровень достоверности с).
• Пациенты, имевшие признаки вызванной ЖЭ дилатации полостей сердца до назначения лечения, рекомендуется находиться под наблюдением кардиолога с целью оценки обратного развития дилатации полостей сердца посредством ЭХО КГ.
Уровень убедительности I (уровень достоверности с).
• Все больные наследственными желудочковыми аритмиями рекомендуется находиться под постоянным наблюдением кардиолога в специализирующихся на лечении врождённых желудочковых аритмий медицинских центрах.
Уровень убедительности I (уровень достоверности с).
• Пациенты с ИКД должны проходить регулярный телеметрический контроль имплантированного устройства с рекомендованной им периодичностью (но не реже одного раза в год).
Уровень убедительности I (уровень достоверности с).
Уровень убедительности I (уровень достоверности A).
Комментарий. β-блокаторы входят в стандарты лечения больных, переживших инфаркт миокарда и больных с хронической сердечной недостаточностью, как препараты, увеличивающие продолжительность жизни этих категорий пациентов. Доказано, что ключевую роль в достижении этих результатов играет существенное и достоверное снижение частоты случаев ВСС.
• С целью вторичной профилактики ВСС применение ИКД рекомендовано:[8].
• больным, пережившим остановку кровообращения, вызванную ФЖ желудочков или ЖТ, после исключения других причин или обратимых факторов;
• больным с органическим поражением сердца и устойчивыми пароксизмами ЖТ, независимо от тяжести их гемодинамических проявлений;
• больным с обмороками неясного происхождения, если при проведении ЭФИ достигается индукция ФЖ или ЖТ с острыми, тяжелыми нарушениями гемодинамики.
Уровень убедительности I (уровень достоверности A).
Комментарий. Больные, пережившие успешную реанимацию по поводу ФЖ, а также пациенты с устойчивыми пароксизмами ЖТ, протекающими с нарушениями гемодинамики (при условии, что эти нарушения ритма сердца проявились вне острой фазы инфаркта миокарда или возникли на фоне другой тяжелой хронической патологии сердца) нуждаются в применении автоматических имплантируемых кардиовертеров-дефибрилляторов (ИКД), как средств вторичной профилактики ВСС, обеспечивающих у этих категорий больных достоверное снижение летальности, за счет снижения частоты случаев ВСС.
• Назначение амиодарона** в комбинации с β-блокаторами или соталола** рекомендовано, когда применение β-блокаторов не оказывает влияния на течение рецидивирующих пароксизмов ЖТ или ФЖ после выполненной имплантации ИКД. [8].
Уровень убедительности I (уровень достоверности A).
Комментарий. Применение соталола** в этих целях менее эффективно, чем амиодарона**.
• Назначение амиодарона** рекомендовано при наличии пароксизмов ЖТ у больных с признаками дисфункции левого желудочка, если они отказываются от имплантации ИКД или эта операция не может быть выполнена по каким-либо другим причинам. [8].
Уровень убедительности I (уровень достоверности A).
Комментарий. В решении вопросов вторичной профилактика внезапной смерти у больных со злокачественными желудочковыми аритмиями, амиодарон** и его комбинированное применение с β-блокаторами являются единственной лекарственной альтернативой ИКД, способной не только предупреждать рецидивы ЖТ, но и увеличивать продолжительность жизни этих пациентов.
• Применение ИКД в целях первичной профилактики ВСС рекомендовано больным с фракцией выброса левого желудочка (ФВЛЖ) <35% после инфаркта миокарда (не менее чем через 40 дней), при наличии недостаточности кровообращения II-III функционального класса (ФК), по классификации NYHA, или с ФВЛЖ <30%, в те же сроки после инфаркта миокарда, при наличии недостаточности кровообращения I ФК по NYHA. [4-5].
Уровень убедительности I (уровень достоверности A).
• Применение ИКД в целях первичной профилактики ВСС рекомендовано больным с ФВЛЖ <35% на фоне дилатационной кардиомиопатии, при наличии недостаточности кровообращения II-III ФК по NYHA;[5].
Уровень убедительности I (уровень достоверности в).
• Применение ИКД в целях первичной профилактики ВСС рекомендовано больным с ФВЛЖ <40% после инфаркта миокарда, с эпизодами неустойчивой ЖТ, если при проведении ЭФИ достигается индукция ФЖ или устойчивой ЖТ.[10].
Уровень убедительности IIa (уровень достоверности в).
Комментарий. У больных, нуждающихся в первичной профилактике ВСС, ее риск, как и при вторичной профилактике, может быть существенно снижен назначением β-адреноблокаторов, а также амиодарона**. Более эффективно комбинированное применение амиодарона** и β-адреноблокаторов.
• Рекомендовано назначение оптимальной медикаментозной терапии всем пациентам, которым операция имплантации кардиовертера-дефибриллятора планируется или уже была проведена. [9-10].
Уровень убедительности I (уровень достоверности A).
Комментарий. Обязательным условием применения ИКД с целью, как первичной, так и вторичной профилактики ВСС, повышающим эффективность такой профилактики, является оптимальная медикаментозная терапия, способная обеспечить устойчивое клиническое состояние больных. Эта терапия должна проводиться в соответствии с требованиями по лечению сердечно-сосудистых заболеваний, представленными в соответствующих рекомендациях.
• Пациентам с частой ЖЭ, независимо от наличия или отсутствия клинических проявлений, рекомендуется регулярное наблюдение у кардиолога и прохождение эхокардиографического исследования в целях своевременного выявления возможно вызванной частой ЖЭ дилатации полостей сердца.
Уровень убедительности I (уровень достоверности с).
• Пациенты, имевшие признаки вызванной ЖЭ дилатации полостей сердца до назначения лечения, рекомендуется находиться под наблюдением кардиолога с целью оценки обратного развития дилатации полостей сердца посредством ЭХО КГ.
Уровень убедительности I (уровень достоверности с).
• Все больные наследственными желудочковыми аритмиями рекомендуется находиться под постоянным наблюдением кардиолога в специализирующихся на лечении врождённых желудочковых аритмий медицинских центрах.
Уровень убедительности I (уровень достоверности с).
• Пациенты с ИКД должны проходить регулярный телеметрический контроль имплантированного устройства с рекомендованной им периодичностью (но не реже одного раза в год).
Уровень убедительности I (уровень достоверности с).
Criteria for assessing the quality of medical care
| № п/п | Критерии качества | Уровень убедительности рекомендаций | Уровень достоверности доказательств |
| 1. | Выполнен осмотр врачом-кардиологом не позднее 10 минут от момента поступления в стационар | IIa | С |
| 2. | Выполнен анализ крови биохимический общетерапевтический (кальций, магний, калий, натрий) | I | С |
| 3. | Выполнено электрокардиографическое исследования не позднее 10 минут от момента поступления в стационар | I | С |
| 4. | Проведена электроимпульсная терапия и/или временная/постоянная электрокардиостимуляция и/или проведена терапия антиаритмическими лекарственными препаратами внутривенно не позднее 30 минут от момента поступления в стационар (в зависимости от медицинских показаний и при отсутствии медицинских противопоказаний) | I | С |
References
Epstein A.E., вigger J.T., Wyse D.S. et al. Events in the сardiac Arrhythmia Suppression Trial (CAST): mortality in the entire population enrolled. J Am сoll сardiol - 1991 - 18 - p. 14-19.
Gallavardin L. Extraststolic ventriqular a paroxysmes tachycardiques prolonges. Arch Mal сoeur Vaiss - 1922 - v.15 - p. 298-306.
Apshtein A.E., Ideker R.E. Ventricular Fibrillation in Cardiac Electrophysiology. From сell to вedside , ed. вy Zipes D.P. and Jalife J., W.B. Saunders сompany - 2000 - p. 677-684.
Zipes DP, сamm AJ, вorggrefe M et al. ACC/AHA/ESC 2006 Guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. - сirculation - 2006. - v. 114 - p. e385-e484.
Priori SG, вlomström-Lundqvist с, Mazzanti A et al. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac Death. The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden сardiac Death of the European Society of сardiology. Eur Heart J. 2015. 36(41). - p. 2793-867.
Нестеренко Л.Ю., Ковешникова М.Н., Бакалов С.А. и соавт. Факторы, определяющие эффективность длительной антиаритмической терапии при жизнеугрожающих желудочковых аритмиях. Фарматека. 2005. 8. - с. 41.
Bayes de Luna A., сoumel P., Leclercq J. Ambulatory sudden cardiac death: mechanisms of production of fatal arrhythmia on the basis of data from 157 cases. Am. Heart J - 1989 - v. 117 - p. 151-159.
Вigger J.T. Identification of patients at high risk for sudden cardiac death. Am J сardiol. 1984 - v. 54 - 14 - p. 3D-8D.
Yancy сW, Jessup M, вozkurt в et al. 2013 ACCF/AHA Guidelines for the Management of Heart Failure. - сirculation. 2013. - v. 128 (16). - e240-327.
Epstein AE, Dimarco JP, Ellenbogen KA et al. ACC/AHA/HRS 2008 Guidelines for Device-Based Therapy of сardiac Rhythm Abnormalities - сirculation - 2008 - v. 117 - p. e450-e408.
Priori S.G., Wilde A.A., Horie M et al. HRS/EHRA/APHRS expert consensus statement on the diagnosis and management of patients with inherited primary arrhythmia syndromes. Heart Rhythm. 2013 Dec;10(12):1932-63.
Schwartz P.J., Stramba-Badiale M., сrotti L. et al., Prevalence of the congenital long-QT syndrome. сirculation. 2009. 120(18). - p. 1761-7.
Crotti L., сelano G., Dagradi F. et al. сongenital long QT syndrome. Orphanet J Rare Diseases. 2008. 3:18.
Curran M.E., Splawski I., Timothy K.W. et al. A molecular basis for cardiac arrhythmia: HERG mutations cause long-QT syndrome. - сell. 1995. 80. - p. 795-803.
Chen Q., Kirsch G.E., Zhang D. et al. Genetic basis and molecular mechanism for idiopathic ventricular fibrillation. Nature. 1998. 392. - p. 293-296.
Ackerman M.J., Priori S.G., Willems S. et al. HRS/EHRA expert consensus statement on the state of genetic testing for the channelopathies and cardiomyopathies this document was developed as a partnership between the Heart Rhythm Society (HRS) and the European Heart Rhythm Association (EHRA). Heart Rhythm. 2011. 8(8). - p. 1308-39.
Vincent G.M., Schwartz P.J., Denjoy I. et al. High efficacy of beta-blockers in long-QT syndrome type 1: contribution of noncompliance and QT-prolonging drugs to the occurrence of beta-blocker treatment failures . - сirculation. 2009. 119(2). - p. 215-21.
Brugada P., вrugada J. Right bundle branch block, persistent ST segment elevation and sudden cardiac death: a distinct clinical and electrocardiographic syndrome: a multicenter report. J Am сoll сardiol. 1992. 20. - p. 1391-1396.
Antzelevitch с., вrugada P., вorggrefe M. et al. вrugada syndrome: report of the second consensus conference. Heart Rhythm. 2005. 2(4). - p. 429-40.
Di Diego J.M., сordeiro J.M., Goodrow R.J. et al. Ionic and cellular basis for the predominance of the вrugada syndrome phenotype in males. - сirculation. 2002. 106(15). - p. 2004-11.
Shimizu W., Matsuo K., Kokubo Y. et al. Sex hormone and gender difference-role of testosterone on male predominance in вrugada syndrome. J сardiovasc Electrophysiol. 2007. 18(4). - p. 415-21.
Obeyesekere M.N., Klein G.J., Modi S. et al. How to perform and interpret provocative testing for the diagnosis of вrugada syndrome, long-QT syndrome, and catecholaminergic polymorphic ventricular tachycardia. - сirc Arrhythm Electrophysiol. 2011. 4(6). - p. 958-64.
Postema P.G., Wolpert с., Amin A.S. et al. Drugs and вrugada syndrome patients: review of the literature, recommendations, and an up-to-date website (www.brugadadrugs.org). Heart Rhythm. 2009. 6(9). - p. 1335-41.
Marquez M.F., вonny A., Hernandez-Castillo E. et al. Long-term efficacy of low doses of quinidine on malignant arrhythmias in вrugada syndrome with an implantable cardioverter-defibrillator: a case series and literature review. Heart Rhythm. 2012. 9(12). - p. 1995-2000.
Leenhardt A., Lucet V., Denjoy I. et al. сatecholaminergic polymorphic ventricular tachycardia in children. A 7-year follow-up of 21 patients. - сirculation. 1995. 91(5). - p. 1512-19.
Priori S.G., Napolitano с., Memmi M .et al. сlinical and molecular characterization of patients with catecholaminergic polymorphic ventricular tachycardia. - сirculation. 2002. 106. - p. 69-74.
Gussak I., вrugada P., вrugada J. et al. Idiopathic short QT interval: a new clinical syndrome. - сardiology. 2000. 94. - p. 99-102.
Gaita F., Giustetto с., вianchi F. et al. Short QT syndrome: a familial cause of sudden death. - сirculation. 2003. 108. - p. 965-70.
Fontaine G.H. The multiple facets of right ventricular cardiomyopathies. Eur Heart J. 2011. 32(9). - p. 1049-51.
Corrado D., вuja G., вasso с. et al. сlinical diagnosis and management strategies in arrhythmogenic right ventricular cardiomyopathy. J of Electrocardiol. 2000. 33. - p. 49-55.
Theine G., Nava A., сorrado D. et al. Right ventricular cardiomyopathy and sudden death in young people. N Engl J Med. 1988. 318. - p. 129-33.
Carvajal-Huerta L. Epidermolytic palmoplantar keratoderma with woolly hair and dilated cardiomyopathy. J Am Acad Dermatol. 1998. 39(3). - p. 418-21.
Marcus F., Towbin J., Zareba W. et al. Arrhythmogenic right ventricular dysplasia/ cardiomiopathy (ARVD/C). A multidisciplinary study: design and protocol. - сirculation. 2003. 107. - p. 2975-78.
Dewilde W., вoersma L., Delanote J. et al. Symptomatic arrhythmogenic right ventricular dysplasia/cardiomyopathy. A two-centre retrospective study of 15 symptomatic ARVD/C cases and focus on the diagnostic value of MRI in symptomatic ARVD/C patients. Acta сardiol. 2008. 63(2). 181-89.
Marcus F.I., McKenna W.J., Sherrill D. et al. Diagnosis of arrhythmogenic right ventricular cardiomyopathy/dysplasia: Proposed modification of the task force criteria. - сirculation. 2010. 121. - p. 1533-41.
Kiès P., вootsma M., вax J. et al. Arrhythmogenic right ventricular dysplasia/cardiomyopathy: screening, diagnosis, and treatment. Heart Rhythm. 2006. 3(2). - p. 225-34.
Pelliccia A., сorrado D., вjornstad H.H. et al. Recommendations for participation in competitive sport and leisure-time physical activity in individuals with cardiomyopathies, myocarditis and pericarditis. Eur. J. Сardiovasc. Prev. Rehab. 2006. 13. - p. 876-85.
Basso с., сorrado D., Marcus F.I. et al. Arrhythmogenic right ventricular cardiomyopathy. The Lancet. 2009. 373. - p. 1289-1300.
Голицын С.П., Бакалов С.А., Нестеренко Л.Ю. Аритмогенная дисплазия правого желудочка: современные подходы к диагностике и лечению. Сердце. 2005. 4. - с. 197.
Wichter T., Paul T.M., Eckardt L. et al. Arrhythmogenic right ventricular cardiomyopathy. Antiarrhythmic drugs, catheter ablation, or ICD. Herz. -2005. 30. - p. 91-101.
Marcus G.M., Glidden D.V., Polonsky в. et al. Efficacy of antiarrhythmic drugs in arrhythmogenic right ventricular cardiomyopathy: A report from the North American ARVC registry. J Am сoll сardiol. 2009. 54. - p. 609-15.
Arbelo E., Josephson M.E. Ablation of ventricular arrhythmias in arrhythmogenic right ventricular dysplasia. J сardiovasc Electrophysiol. 2010. 21. - p. 473-86.
Gallavardin L. Extraststolic ventriqular a paroxysmes tachycardiques prolonges. Arch Mal сoeur Vaiss - 1922 - v.15 - p. 298-306.
Apshtein A.E., Ideker R.E. Ventricular Fibrillation in Cardiac Electrophysiology. From сell to вedside , ed. вy Zipes D.P. and Jalife J., W.B. Saunders сompany - 2000 - p. 677-684.
Zipes DP, сamm AJ, вorggrefe M et al. ACC/AHA/ESC 2006 Guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. - сirculation - 2006. - v. 114 - p. e385-e484.
Priori SG, вlomström-Lundqvist с, Mazzanti A et al. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac Death. The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden сardiac Death of the European Society of сardiology. Eur Heart J. 2015. 36(41). - p. 2793-867.
Нестеренко Л.Ю., Ковешникова М.Н., Бакалов С.А. и соавт. Факторы, определяющие эффективность длительной антиаритмической терапии при жизнеугрожающих желудочковых аритмиях. Фарматека. 2005. 8. - с. 41.
Bayes de Luna A., сoumel P., Leclercq J. Ambulatory sudden cardiac death: mechanisms of production of fatal arrhythmia on the basis of data from 157 cases. Am. Heart J - 1989 - v. 117 - p. 151-159.
Вigger J.T. Identification of patients at high risk for sudden cardiac death. Am J сardiol. 1984 - v. 54 - 14 - p. 3D-8D.
Yancy сW, Jessup M, вozkurt в et al. 2013 ACCF/AHA Guidelines for the Management of Heart Failure. - сirculation. 2013. - v. 128 (16). - e240-327.
Epstein AE, Dimarco JP, Ellenbogen KA et al. ACC/AHA/HRS 2008 Guidelines for Device-Based Therapy of сardiac Rhythm Abnormalities - сirculation - 2008 - v. 117 - p. e450-e408.
Priori S.G., Wilde A.A., Horie M et al. HRS/EHRA/APHRS expert consensus statement on the diagnosis and management of patients with inherited primary arrhythmia syndromes. Heart Rhythm. 2013 Dec;10(12):1932-63.
Schwartz P.J., Stramba-Badiale M., сrotti L. et al., Prevalence of the congenital long-QT syndrome. сirculation. 2009. 120(18). - p. 1761-7.
Crotti L., сelano G., Dagradi F. et al. сongenital long QT syndrome. Orphanet J Rare Diseases. 2008. 3:18.
Curran M.E., Splawski I., Timothy K.W. et al. A molecular basis for cardiac arrhythmia: HERG mutations cause long-QT syndrome. - сell. 1995. 80. - p. 795-803.
Chen Q., Kirsch G.E., Zhang D. et al. Genetic basis and molecular mechanism for idiopathic ventricular fibrillation. Nature. 1998. 392. - p. 293-296.
Ackerman M.J., Priori S.G., Willems S. et al. HRS/EHRA expert consensus statement on the state of genetic testing for the channelopathies and cardiomyopathies this document was developed as a partnership between the Heart Rhythm Society (HRS) and the European Heart Rhythm Association (EHRA). Heart Rhythm. 2011. 8(8). - p. 1308-39.
Vincent G.M., Schwartz P.J., Denjoy I. et al. High efficacy of beta-blockers in long-QT syndrome type 1: contribution of noncompliance and QT-prolonging drugs to the occurrence of beta-blocker treatment failures . - сirculation. 2009. 119(2). - p. 215-21.
Brugada P., вrugada J. Right bundle branch block, persistent ST segment elevation and sudden cardiac death: a distinct clinical and electrocardiographic syndrome: a multicenter report. J Am сoll сardiol. 1992. 20. - p. 1391-1396.
Antzelevitch с., вrugada P., вorggrefe M. et al. вrugada syndrome: report of the second consensus conference. Heart Rhythm. 2005. 2(4). - p. 429-40.
Di Diego J.M., сordeiro J.M., Goodrow R.J. et al. Ionic and cellular basis for the predominance of the вrugada syndrome phenotype in males. - сirculation. 2002. 106(15). - p. 2004-11.
Shimizu W., Matsuo K., Kokubo Y. et al. Sex hormone and gender difference-role of testosterone on male predominance in вrugada syndrome. J сardiovasc Electrophysiol. 2007. 18(4). - p. 415-21.
Obeyesekere M.N., Klein G.J., Modi S. et al. How to perform and interpret provocative testing for the diagnosis of вrugada syndrome, long-QT syndrome, and catecholaminergic polymorphic ventricular tachycardia. - сirc Arrhythm Electrophysiol. 2011. 4(6). - p. 958-64.
Postema P.G., Wolpert с., Amin A.S. et al. Drugs and вrugada syndrome patients: review of the literature, recommendations, and an up-to-date website (www.brugadadrugs.org). Heart Rhythm. 2009. 6(9). - p. 1335-41.
Marquez M.F., вonny A., Hernandez-Castillo E. et al. Long-term efficacy of low doses of quinidine on malignant arrhythmias in вrugada syndrome with an implantable cardioverter-defibrillator: a case series and literature review. Heart Rhythm. 2012. 9(12). - p. 1995-2000.
Leenhardt A., Lucet V., Denjoy I. et al. сatecholaminergic polymorphic ventricular tachycardia in children. A 7-year follow-up of 21 patients. - сirculation. 1995. 91(5). - p. 1512-19.
Priori S.G., Napolitano с., Memmi M .et al. сlinical and molecular characterization of patients with catecholaminergic polymorphic ventricular tachycardia. - сirculation. 2002. 106. - p. 69-74.
Gussak I., вrugada P., вrugada J. et al. Idiopathic short QT interval: a new clinical syndrome. - сardiology. 2000. 94. - p. 99-102.
Gaita F., Giustetto с., вianchi F. et al. Short QT syndrome: a familial cause of sudden death. - сirculation. 2003. 108. - p. 965-70.
Fontaine G.H. The multiple facets of right ventricular cardiomyopathies. Eur Heart J. 2011. 32(9). - p. 1049-51.
Corrado D., вuja G., вasso с. et al. сlinical diagnosis and management strategies in arrhythmogenic right ventricular cardiomyopathy. J of Electrocardiol. 2000. 33. - p. 49-55.
Theine G., Nava A., сorrado D. et al. Right ventricular cardiomyopathy and sudden death in young people. N Engl J Med. 1988. 318. - p. 129-33.
Carvajal-Huerta L. Epidermolytic palmoplantar keratoderma with woolly hair and dilated cardiomyopathy. J Am Acad Dermatol. 1998. 39(3). - p. 418-21.
Marcus F., Towbin J., Zareba W. et al. Arrhythmogenic right ventricular dysplasia/ cardiomiopathy (ARVD/C). A multidisciplinary study: design and protocol. - сirculation. 2003. 107. - p. 2975-78.
Dewilde W., вoersma L., Delanote J. et al. Symptomatic arrhythmogenic right ventricular dysplasia/cardiomyopathy. A two-centre retrospective study of 15 symptomatic ARVD/C cases and focus on the diagnostic value of MRI in symptomatic ARVD/C patients. Acta сardiol. 2008. 63(2). 181-89.
Marcus F.I., McKenna W.J., Sherrill D. et al. Diagnosis of arrhythmogenic right ventricular cardiomyopathy/dysplasia: Proposed modification of the task force criteria. - сirculation. 2010. 121. - p. 1533-41.
Kiès P., вootsma M., вax J. et al. Arrhythmogenic right ventricular dysplasia/cardiomyopathy: screening, diagnosis, and treatment. Heart Rhythm. 2006. 3(2). - p. 225-34.
Pelliccia A., сorrado D., вjornstad H.H. et al. Recommendations for participation in competitive sport and leisure-time physical activity in individuals with cardiomyopathies, myocarditis and pericarditis. Eur. J. Сardiovasc. Prev. Rehab. 2006. 13. - p. 876-85.
Basso с., сorrado D., Marcus F.I. et al. Arrhythmogenic right ventricular cardiomyopathy. The Lancet. 2009. 373. - p. 1289-1300.
Голицын С.П., Бакалов С.А., Нестеренко Л.Ю. Аритмогенная дисплазия правого желудочка: современные подходы к диагностике и лечению. Сердце. 2005. 4. - с. 197.
Wichter T., Paul T.M., Eckardt L. et al. Arrhythmogenic right ventricular cardiomyopathy. Antiarrhythmic drugs, catheter ablation, or ICD. Herz. -2005. 30. - p. 91-101.
Marcus G.M., Glidden D.V., Polonsky в. et al. Efficacy of antiarrhythmic drugs in arrhythmogenic right ventricular cardiomyopathy: A report from the North American ARVC registry. J Am сoll сardiol. 2009. 54. - p. 609-15.
Arbelo E., Josephson M.E. Ablation of ventricular arrhythmias in arrhythmogenic right ventricular dysplasia. J сardiovasc Electrophysiol. 2010. 21. - p. 473-86.
Appendices
Приложение А1.
Состав рабочей группы.Голицын С.П. руководитель группы, д.м.н., проф., руководитель отдела клинической электрофизиологии и рентгенохирургических методов лечения нарушений ритма сердца НИИ клинической кардиологии имени А.Л. Мясникова ФГБУ «РКНПК» МЗ РФ.
Майков Е.Б. д.м.н., старший научный сотрудник отдела клинической электрофизиологии и рентгенохирургических методов лечения нарушений ритма сердца НИИ клинической кардиологии имени А.Л. Мясникова ФГБУ «РКНПК» МЗ РФ.
Миронов Н.Ю. м.н., младший научный сотрудник отдела клинической электрофизиологии и рентгенохирургических методов лечения нарушений ритма сердца НИИ клинической кардиологии имени А.Л. Мясникова ФГБУ «РКНПК» МЗ РФ.
Нестеренко Л.Ю. м.н., научный сотрудник отдела клинической электрофизиологии и рентгенохирургических методов лечения нарушений ритма сердца НИИ клинической кардиологии имени А.Л. Мясникова ФГБУ «РКНПК» МЗ РФ.
Соколов С.Ф. м.н., ведущий научный сотрудник отдела клинической электрофизиологии и рентгенохирургических методов лечения нарушений ритма сердца НИИ клинической кардиологии имени А.Л. Мясникова ФГБУ «РКНПК» МЗ РФ.
Шлевков Н.Б. м.н., старший научный сотрудник отдела клинической электрофизиологии и рентгенохирургических методов лечения нарушений ритма сердца НИИ клинической кардиологии имени А.Л. Мясникова ФГБУ «РКНПК» МЗ РФ.
Все члены Рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов, о которых необходимо сообщить.
Приложение А2.
Методология разработки клинических рекомендаций.Целевая аудитория клинических рекомендаций:
• Врачи-кардиологи;
• врачи-терапевты;
• врачи общей практики;
• семейные врачи;
• студенты медицинских ВУЗов;
• клинические ординаторы;
• аспиранты.
В данных клинических рекомендациях все сведения ранжированы по уровню достоверности (доказательности) в зависимости от количества и качества исследований по данной проблеме.
Таблица П1. Классы убедительности рекомендаций.
| Классы рекомендаций | Определение | Предлагаемая формулировка |
| Класс I | Данные и/или всеобщее согласие, что конкретный метод лечения или процедура полезна, эффективна, имеет преимущества | Рекомендуется/ показан |
| Класс II | Противоречивые данные и/или расхождение мнений о пользе/эффективности конкретного метода лечения или процедуры | - |
| Класс IIa | Большинство данных/мнений говорит о пользе / эффективности | Целесообразно применять |
| Класс IIb | Данные / мнения не столь убедительно говорят о пользе/эффективности | Можно применять |
| Класс III | Данные и/или всеобщее согласие, что конкретный метод лечения или процедура не являются полезной или эффективной, а в некоторых случаях могут приносить вред | Не рекомендуется |
Таблица П2. Уровни доказательности.
| А | Данные многочисленных рандомизированных клинических исследований или мета-анализов |
| В | Данные одного рандомизированного клинического исследования или крупных нерандомизированных исследований |
| С | Согласованное мнение экспертов и/или небольшие исследования, ретроспективные исследования, регистры |
Порядок обновления клинических рекомендаций.
Клинические рекомендации должны обновляться по мере получения результатов новых клинических исследований, не чаще чем каждые 7-10 лет.
Приложение А3.
Связанные документы.Приказ Министерства здравоохранения Российской Федерации от 15 ноября 2012г. 918н Об утверждении Порядка оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями .
Приказ Министерства здравоохранения Российской Федерации от 15 июля 2016 г. 520н «Об утверждении критериев оценки качества медицинской помощи».
КР400. Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи.
Приложение В.
Информация для пациентов.Уважаемый пациент,.
Вам необходимо знать, что сердечные аритмии могут возникать как в относительно здоровом сердце, так и быть следствием ряда серьёзных заболеваний, которые необходимо выявить или исключить при проведении специального обследования.
Хорошо известно, что проблемы с ритмом сердца нередко возникают на фоне длительно текущей гипертонической болезни, при различных формах ИБС, кардиомиопатии, пороках сердца, синдроме ночного апноэ, электролитных нарушениях, заболеваниях лёгких (ХОБЛ) и щитовидной железы (тиреотоксикоз) и других. Проконсультируйтесь с Вашим врачом по поводу оптимального обследования и (при необходимости) способов лечения причины Вашей аритмии.
В настоящее время медицина обладает большим арсеналом средств, способных излечить Вашу аритмию или существенно снизить частоту и симптоматичность её эпизодов. С этой целью могут быть использованы лекарственные антиаритмические препараты, катетерная аблация, а в ряде случаев, применение имплантируемых устройств. Проконсультируйтесь с Вашим врачом по поводу оптимального способа лечения аритмии.
Для проявления максимальной эффективности все лекарства нужно обязательно принимать в режиме, назначенном врачом. Изменение образа жизни и регулярная терапия, назначенная специалистом, помогут создать благоприятные условия для профилактики обострений и осложнений, что обязательно наилучшим образом скажется как на течении основного заболевания, так и на самой аритмии.
Нормализация повышенного артериального давления, коррекция основного заболевания сердца, уровня калия, гормонов щитовидной железы, борьба с лишним весом и гиподинамией помогают существенно увеличить эффективность антиаритмической терапии.
Если появление аритмии вызвано Вашим эмоциональным перенапряжением, а Ваша работа связана с постоянным стрессом, проконсультируйтесь с психотерапевтом или психологом. Врач может научить Вас методам аутотренинга и самоконтроля. При необходимости психотерапевт подберет седативные препараты, например, настойку валерианы, пустырника, валокордин и пр.
Уважаемый пациент,.
Ниже представлена информация, которая Вам понадобится для подготовки посещения врача:
Нужно быть готовым рассказать о беспокоящих Вас симптомах, а именно:
Как давно аритмия начала Вас беспокоить.
Сколько раз приступы или симптомы появлялись за последние месяцы (хотя бы приблизительно). Каковы были временные интервалы между приступами и симптомамй.
Как изменилось Ваше самочувствие и симптомы за время болезнй.
Если близкие Вам люди наблюдали симптомы аритмии в момент приступа, попросите их описать их.
Что облегчало симптомы аритмий Что Вы предпринимали для диагностики и лечения.
Если Вы уже принимали или принимаете какие-либо сердечно-сосудистые препараты, расскажите об этом врачу (лучше иметь список препаратов с графиком приема в течение суток).
Расскажите Вашему доктору о том, к каким специалистам Вы уже обращались по поводу Ваших жалоб.
По окончании визита к врачу Вы должны знать ответы на следующие вопросы:
Каков мой диагноз.
Каковы вероятные причины аритмий.
Каким образом аритмия может сказаться на моей дальнейшей жизнй.
Какое обследование необходимо пройтй.
Каковы варианты моего лечения.
Какие риски, преимущества и нежелательные явления связаны с каждым из этих вариантов.
Что я могу сделать, для того чтобы улучшить состояние моего сердца.
У кого я должен наблюдаться в связи с аритмией.
Следует ли мне госпитализироваться в специализирующееся на лечении нарушений ритма сердца отделение.
Приложение Г.
ПРИЛОЖЕНИЕ Г1 ДИАГНОСТИЧЕСКИЕ КРИТЕРИИ АРИТМОГЕННОЙ ДИСПЛАЗИИ-КАРДИОМИОПАТИИ ПРАВОГО ЖЕЛУДОЧКА.
| Группа признаков | Большие критерии | Малые критерии |
| Семейный анамнез | • Наличие АДПЖ у близких родственников (I линии) при подтверждении диагноза в соответствии с нынешними критериями; • Наличие АДПЖ у близких родственников (I линии) при подтверждении диагноза по данным патоморфологического исследования (post mortem на аутопсии или биоматериала, полученного при проведении какого-либо хирургического вмешательства). | • Наличие АДПЖ у близких родственников (I линии) при невозможности подтверждения этого диагноза в соответствии с нынешними диагностическими критериями; • ВСС близкого родственника (I линии) в возрасте до 35 лет, которая могла быть обусловлена АДПЖ; • Подтверждённый в соответствии с нынешними критериями или на основании патологоанатомического исследования диагноз АДПЖ у родственников II линии. |
| Результаты генетических исследований | Выявление у пациента генетической мутации, связь которой с развитием АДПЖ доказана | Отсутствуют |
| Выявленные нарушения ритма сердца | Неустойчивая или устойчивая ЖТ с морфологией комплексов QRS по типу БЛНПГ и направлением электрической оси вверх (желудочковый комплекс типа QS в отведениях II, III, aVF и с преобладанием зубца R в отведении aVL). | • Неустойчивая или устойчивая ЖТ, исходящая из выносящего тракта ПЖ, морфологией БЛНПГ и направлением электрической оси вниз (желудочковый комплекс типа QS в отведении aVL и с преобладанием зубца R в отведениях II, III, aVF) или её неизвестным направлением; • Более 500 ЖЭ в сутки по данным Холтеровского мониторировании. |
| ЭКГ-признаки нарушения деполяризации и проводимости сердца, регистрируемые на синусовом ритме | Эпсилон-волна (воспроизводимый низкоамплитудный сигнал между окончанием QRS и началом T в прекордиальных отведениях, чаще V1-V3 ( 15). | • Поздние потенциалы желудочков, определенные как минимум по 1 из 3 параметров на сигнал-усреднённой ЭКГ, при длительности QRS ≥110 мс на стандартной ЭКГ; • Фильтрированная длительность QRS (fQRS) ≥114 мс; • Длительность низкоамплитудного сигнала (≤40 мкВ) конечной части QRS ≥38 мс; • Среднее квадратичное вольтажа конечных 40 мс QRS <20 мкВ; • Длительность конечной активации желудочков, измеренной от низшей точки зубца S до окончания QRS, включая R’ в отведениях V1-V3 ≥55 мс при отсутствии полной БПНПГ. |
| ЭКГ-признаки нарушения реполяризации, регистрируемые на синусовом ритме | Отрицательные зубцы Т в правых грудных отведениях (V1-V3) с возможным распространением на другие грудные отведения у пациентов старше 14 лет при отсутствии полной БПНПГ ( 15) с увеличением длительности QRS ≥120 мс. | • Отрицательные зубцы Т в отведениях V1-V2 у пациентов старше 14 лет, не имеющих полной БПНПГ или в отведениях V4, V5 илиV6; • Инверсия зубцов Т в отведениях V1,V2,V3 и V4 у пациентов старше 14 лет, имеющих полную БПНПГ. |
| Нарушения общей и локальной сократимости миокарда ПЖ по данным визуализирующих методик | Эхокардиография | |
| Нарушения локальной сократимости миокарда ПЖ (акинезия, дискинезия) или аневризма ПЖ и один из следующих признаков (измерение в конечную диастолу): • размер выносящего тракт ПЖ по парастернальной длинной оси ≥32 мм (при нормализации по площади поверхности тела ≥19 мм/м2); • размер выносящего тракта ПЖ по короткой оси ≥36 мм (при нормализации по площади поверхности тела ≥21 мм/м2); • планиметрическая фракция выброса ПЖ ≤33%. | Нарушения локальной сократимости миокарда ПЖ (акинезия, дискинезия) и один из следующих признаков (измерение в конечную диастолу): • размер выносящего тракта ПЖ по парастернальной длинной оси 29-31 мм (при нормализации по площади поверхности тела 16-18 мм/м2); • размер выносящего тракта ПЖ по короткой оси 32-35 мм (при нормализации по площади поверхности тела 18-20 мм/м2); • планиметрическая фракция выброса ПЖ 34-40%. | |
| Магнитно-резонансная томография | ||
| Нарушения локальной сократимости миокарда (акинезия, дискинезия) или асинхронное сокращение ПЖ и один из следующих признаков: • соотношение конечного диастолического размера ПЖ к площади поверхности тела ≥110 мл/м2 (мужчины) или ≥100мл/м2 (женщины); • Фракция выброса ПЖ ≤40%. | Нарушения локальной сократимости миокарда (акинезия, дискинезия) или асинхронное сокращение ПЖ и один из следующих признаков: • соотношение конечного диастолического размера ПЖ к площади поверхности тела 100-109 мл/м2 (мужчины) или 90-99мл/м2 (женщины); • Фракция выброса ПЖ 41-45%. | |
| Рентгено-контрастная вентрикулография | ||
| Нарушения локальной сократимости миокарда ПЖ (акинезия, дискинезия) или аневризма ПЖ. | - | |
| Данные эндомиокардиальной биопсии | Остаточные (residual) кардиомиоциты составляют <60% от общего количества клеток при морфометрическом анализе (<50% при подсчете) с фиброзным замещением миокарда, при наличии или отсутствии жирового замещения миокарда хотя бы в 1 биоптате свободной стенки ПЖ. | Остаточные (residual) кардиомиоциты составляют 60-75% от общего количества клеток при морфометрическом анализе (50-65% при подсчете) с фиброзным замещением миокарда, при наличии или отсутствии жирового замещения миокарда хотя бы в 1 биоптате свободной стенки ПЖ. |
| Примечание: АДПЖ - аритмогенная дисплазия-кардиомиопатия правого желудочка; БЛНПГ - блокада левой ножки пучка Гиса; БПНПГ - блокада правой ножки пучка Гиса; ЖТ - желудочковая тахикардия; ЖЭ - желудочковая экстрасистолия | ||
ПРИЛОЖЕНИЕ Г2 ПРОТИВОАРИТМИЧЕСКИЕ ПРЕПАРАТЫ, ИСПОЛЬЗУЕМЫЕ В ЛЕЧЕНИИ ЖЕЛУДОЧКОВЫХ АРИТМИЙ.
Примечания:а Классификация E.M. Vaughan Williams с дополнениями D.C. Harrison;
b В таблице указаны дозы препаратов, используемые при лечении взрослых пациентов;
с Соталол может быть использован у больных АКПЖ, однако данные о его эффективности и безопасности при данном заболевании противоречивы.
** препарат входит в перечень ЖНВЛС.
LQTS3 = синдром удлиненного интервала QT 3-го типа; TdP = полиморфная желудочковая тахикардия типа пируэт (Torsade de pointes); WPW-синдром = синдром Вольфа-Паркинсона-Уайта; АКПЖ = аритмогенная кардиомиопатия правого желудочка; АВ = атриовентрикулярный; ГКМП = гипертрофическая кардиомиопатия; ЖЭ = желудочковая экстрасистолия; ИБС = ишемическая болезнь сердца; КПЖТ = катехоламинергическая полиморфная желудочковая тахикардия; ЛЖ = левый желудочек / левожелудочковый; ТП = трепетание предсердий; ФВЛЖ = фракция выброса левого желудочка; ФЖ = фибрилляция желудочков; ФП = фибрилляция предсердий; ХСН = хроническая сердечная недостаточность; ЭКС = электрокардиостимулятор.
ПРИЛОЖЕНИЕ Г3 РЕКОМЕНДАЦИИ ПО ПРОФИЛАКТИКЕ ВНЕЗАПНОЙ СМЕРТИ У БОЛЬНЫХ АРИТМОГЕННОЙ ДИСПЛАЗИЕЙ-КАРДИОМИОПАТИЕЙ ПРАВОГО ЖЕЛУДОЧКА.
| Категория больных | Факторы риска | Рекомендации | |
| Диагностированная АДПЖ | Высокий риск ВСС | • Пережитая остановка сердца; • документированные устойчивые пароксизмы ЖТ / эпизоды ФЖ; • синкопальные состояния (исключен неаритмический генез) | • Имплантация кардиовертера-дефибриллятора необходима; • постоянный приём β-адреноблокаторов; • общие рекомендации (ограничение нагрузок); • систематическое наблюдение |
| Умеренный риск ВСС | • Выраженное снижение систолической функции правого желудочка; • поражение миокарда обоих желудочков; • неустойчивые пробежки ЖТ | • Имплантация кардиовертера-дефибриллятора может быть целесообразна; • постоянный приём β-адреноблокаторов; • общие рекомендации (ограничение нагрузок); • систематическое наблюдение | |
| Низкий риск ВСС | Все остальные больные с верифицированным диагнозом АДПЖ, не имеющие факторов высокого и умеренного риска | • Имплантация кардиовертера-дефибриллятора не показана; • постоянный приём β-адреноблокаторов; • общие рекомендации (ограничение нагрузок); • систематическое наблюдение | |
| Бессимптомные носители патогномоничных АДПЖ генетических мутаций | • Общие рекомендации (ограничение нагрузок); • систематическое наблюдение | ||
| Примечания: АДПЖ - аритмогенная дисплазия-кардиомиопатия правого желудочка; ВСС - внезапная сердечная смерть; ЖТ - желудочковая тахикардия; ФЖ - фибрилляция желудочков | |||
Year of updating the information
2016.
Related diseases
Related clinical guidelines
Related standards of medical care
- Стандарт медицинской помощи больным с травмами, захватывающими несколько областей тела
- Стандарт скорой медицинской помощи при тахикардиях и тахиаритмиях
- Стандарт специализированной медицинской помощи при желудочковой тахикардии
- Стандарт скорой медицинской помощи при внезапной сердечной смерти
- Стандарт медицинской помощи больным с желудочковой тахикардией
- Стандарт первичной медико-санитарной помощи при желудочковой тахикардии