ICD-10 codes
- ICD-10
- C83.7 Burkitt lymphoma
Introduction
МКБ 10: С83.7.
Год утверждения (частота пересмотра): 2017 (пересмотр каждые 2 года).
ID: КР135.
Профессиональные ассоциации.
• Национальное гематологическое общество Российское профессиональное общество онкогематологов.
Год утверждения (частота пересмотра): 2017 (пересмотр каждые 2 года).
ID: КР135.
Профессиональные ассоциации.
• Национальное гематологическое общество Российское профессиональное общество онкогематологов.
Professional associations
• Национальное гематологическое общество Российское профессиональное общество онкогематологов.
 List of abbreviations
List of abbreviations
C-MYC - ген, транскрипционный фактор, протоонкоген.
CD - кластеры дифференцировки.
FISH - флюоресцентная гибридизация in situ.
IGH - ген, кодирующий тяжелую цепь иммуноглобулина.
IGL - ген, кодирующий легкую цепь иммуноглобулина.
MYC - белок, кодируемый геном c-MYC.
TP53 - ген, кодирующий транскрипционный фактор, регулирующий клеточный цикл, антионкоген.
ВААРТ - высокоактивная антиретровирусная терапия.
В-ОЛЛ - В-острый лимфобластный лейкоз.
ВИЧ - вирус иммунодефицита человека.
ВЭБ - вирус Эпштейна-Барр.
КМ - костный мозг.
КТ - компьютерная томография.
ЛБ - лимфома Беркитта.
MРT - магнитно-резонансная томография.
ОПН - острая почечная недостаточность.
ПХТ - полихимиотерапия.
СМЦО - синдром массивного цитолиза опухоли.
ТГСК - трансплантация гемопоэтических стволовых клеток.
ЦНС - центральная нервная система.
CD - кластеры дифференцировки.
FISH - флюоресцентная гибридизация in situ.
IGH - ген, кодирующий тяжелую цепь иммуноглобулина.
IGL - ген, кодирующий легкую цепь иммуноглобулина.
MYC - белок, кодируемый геном c-MYC.
TP53 - ген, кодирующий транскрипционный фактор, регулирующий клеточный цикл, антионкоген.
ВААРТ - высокоактивная антиретровирусная терапия.
В-ОЛЛ - В-острый лимфобластный лейкоз.
ВИЧ - вирус иммунодефицита человека.
ВЭБ - вирус Эпштейна-Барр.
КМ - костный мозг.
КТ - компьютерная томография.
ЛБ - лимфома Беркитта.
MРT - магнитно-резонансная томография.
ОПН - острая почечная недостаточность.
ПХТ - полихимиотерапия.
СМЦО - синдром массивного цитолиза опухоли.
ТГСК - трансплантация гемопоэтических стволовых клеток.
ЦНС - центральная нервная система.
Terms and definitions
Лимфома Беркитта (ЛБ). Высоко агрессивная лимфома из иммунологически зрелых В-клеток с преимущественно экстранодальной локализацией.
Клинически выделяют 3 варианта ЛБ: эндемический, спорадический и ВИЧ-ассоциированный.
Эндемический вариант ЛБ характерен для темнокожих детей-аборигенов экваториальной Африки и мигрантов из Африки в Новую Гвинею. В клинической картине часто наблюдается поражение лицевого скелета: верхней и нижней челюстей, орбиты, а также почек, яичек, яичников, слюнных, молочных желез и центральной нервной системы.
Спорадический вариант ЛБ. Типичная ЛБ по морфологическим, иммунофенотипическим и цитогенетическим признакам, возникающая вне эндемичной зоны.
Иммунодефицит-ассоциированный вариант ЛБ. ЛБ, возникающая на фоне иммунодефицитных состояний (у больных ВИЧ-инфекцией, после трансплантации органов, у больных первичными иммунодефицитами). Чаще всего встречается у ВИЧ-инфицированных больных, причем на ранних этапах развития (до снижения сD4+ клеток). Болеют преимущественно мужчины. Частыми проявлениями заболевания являются лимфаденопатия, спленомегалия, вовлечение в опухолевый процесс костного мозга.
Клинически выделяют 3 варианта ЛБ: эндемический, спорадический и ВИЧ-ассоциированный.
Эндемический вариант ЛБ характерен для темнокожих детей-аборигенов экваториальной Африки и мигрантов из Африки в Новую Гвинею. В клинической картине часто наблюдается поражение лицевого скелета: верхней и нижней челюстей, орбиты, а также почек, яичек, яичников, слюнных, молочных желез и центральной нервной системы.
Спорадический вариант ЛБ. Типичная ЛБ по морфологическим, иммунофенотипическим и цитогенетическим признакам, возникающая вне эндемичной зоны.
Иммунодефицит-ассоциированный вариант ЛБ. ЛБ, возникающая на фоне иммунодефицитных состояний (у больных ВИЧ-инфекцией, после трансплантации органов, у больных первичными иммунодефицитами). Чаще всего встречается у ВИЧ-инфицированных больных, причем на ранних этапах развития (до снижения сD4+ клеток). Болеют преимущественно мужчины. Частыми проявлениями заболевания являются лимфаденопатия, спленомегалия, вовлечение в опухолевый процесс костного мозга.
Description
Лимфома Беркитта (ЛБ). Высоко агрессивная лимфома из иммунологически зрелых В-клеток с преимущественно экстранодальной локализацией [1]. При гистологическом исследовании выявляется диффузный рост мономорфных клеток среднего размера с округлыми ядрами, высоким ядерно-цитоплазматическим соотношением, выраженными морфологическими признаками апоптоза. Типична картина «звездного неба»( макрофаги с фрагментами апоптотических телец в цитоплазме). Опухоль имеет иммунофенотип сD20+, сD10+, сD38+, вCL-6+, вCL-2-, сD44-, TdT-, сD3-, EBER (ISH)-/+. Индекс пролиферативной активности опухолевых клеток Ki-67 приближается к 100%. В редких случаях часть опухолевых клеток слабо экспрессирует вCL-2 (цитоплазматическая реакция).
Клинически выделяют 3 варианта ЛБ. Эндемический, спорадический и ВИЧ-ассоциированный.
Эндемический вариант ЛБ характерен для темнокожих детей-аборигенов экваториальной Африки и мигрантов из Африки в Новую Гвинею. В клинической картине часто наблюдается поражение лицевого скелета: верхней и нижней челюстей, орбиты, а также почек, яичек, яичников, слюнных, молочных желез и центральной нервной системы.
Спорадический вариант ЛБ - типичная ЛБ по морфологическим, иммунофенотипическим и цитогенетическим признакам, возникающая вне эндемичной зоны.
Иммунодефицит-ассоциированный вариант ЛБ - ЛБ, возникающая на фоне иммунодефицитных состояний (у больных ВИЧ-инфекцией, после трансплантации органов, у больных первичными иммунодефицитами). Чаще всего встречается у ВИЧ-инфицированных больных, причем на ранних этапах развития (до снижения сD4+ клеток). Болеют преимущественно мужчины. Частыми проявлениями заболевания являются лимфаденопатия, спленомегалия, вовлечение в опухолевый процесс костного мозга.
Клинически выделяют 3 варианта ЛБ. Эндемический, спорадический и ВИЧ-ассоциированный.
Эндемический вариант ЛБ характерен для темнокожих детей-аборигенов экваториальной Африки и мигрантов из Африки в Новую Гвинею. В клинической картине часто наблюдается поражение лицевого скелета: верхней и нижней челюстей, орбиты, а также почек, яичек, яичников, слюнных, молочных желез и центральной нервной системы.
Спорадический вариант ЛБ - типичная ЛБ по морфологическим, иммунофенотипическим и цитогенетическим признакам, возникающая вне эндемичной зоны.
Иммунодефицит-ассоциированный вариант ЛБ - ЛБ, возникающая на фоне иммунодефицитных состояний (у больных ВИЧ-инфекцией, после трансплантации органов, у больных первичными иммунодефицитами). Чаще всего встречается у ВИЧ-инфицированных больных, причем на ранних этапах развития (до снижения сD4+ клеток). Болеют преимущественно мужчины. Частыми проявлениями заболевания являются лимфаденопатия, спленомегалия, вовлечение в опухолевый процесс костного мозга.
Reasons
Основным событием патогенеза ЛБ является усиление экспрессии протоонкогена c-MYC за счет различных механизмов [1].
Приблизительно 95-100 % случаев эндемической ЛБ связаны с вирусом Эпштейна-Барр (ВЭБ). Длительная персистенция ВЭБ в организме и накопление дополнительных онкогенных событий способствуют вирус-обусловленной трансформации В-клеток, активация экспрессии с-MYC. Дополнительным фактором для развития ЛБ служат мутации в гене TP53, что в ряде случаев приводит к нивелированию антионкогенного действия TP53.
В случае спорадической ЛБ гиперэкспрессия с-MYC возникает в подавляющем большинстве случаев в результате транслокации с участием локуса гена c-MYC. Как правило, транслокация происходит с партнерским локусом тяжелой цепи иммуноглобулина - t(8;14)(q24;q32), в 20 % - с локусами легких цепей иммуноглобулина: в 15 % - с локусом λ-цепи t(8;22)(q34;q11), в 5 % - с локусом κ-цепи t(2;8)(p11;q24). При транслокации c-MYC встраивается в район гена IGH или IGL, при этом оказываясь в области активированных в в-клетках IGH или IGL энхансеров, что приводит к непрерывной экспрессии c-MYC. Также усиление экспрессии c-MYC происходит за счет его структурных повреждений (мутаций), что ведет к изменению регуляции экспрессии и функции продукта гена c-Белок MYC работает как фактор транскрипции и регулирует клеточную пролиферацию, дифференцировку и апоптоз.
В случае ВИЧ-ассоциированной ЛБ ВИЧ, подобно Plasmodium falciparum, стимулирует поликлональную активацию В-клеток и способствует их избыточной пролиферации. ВИЧ инициирует развитие лимфомы опосредованно через цитокиновые нарушения, длительную антигенную стимуляцию и подавление функции иммунологического контроля. Частота возникновения ЛБ в 23 раза выше у лиц, перенесших трансплантацию печени, сердца и почек. Как правило, ЛБ диагностируется у этой категории пациентов через 3-8 лет после проведенной трансплантации.
Приблизительно 95-100 % случаев эндемической ЛБ связаны с вирусом Эпштейна-Барр (ВЭБ). Длительная персистенция ВЭБ в организме и накопление дополнительных онкогенных событий способствуют вирус-обусловленной трансформации В-клеток, активация экспрессии с-MYC. Дополнительным фактором для развития ЛБ служат мутации в гене TP53, что в ряде случаев приводит к нивелированию антионкогенного действия TP53.
В случае спорадической ЛБ гиперэкспрессия с-MYC возникает в подавляющем большинстве случаев в результате транслокации с участием локуса гена c-MYC. Как правило, транслокация происходит с партнерским локусом тяжелой цепи иммуноглобулина - t(8;14)(q24;q32), в 20 % - с локусами легких цепей иммуноглобулина: в 15 % - с локусом λ-цепи t(8;22)(q34;q11), в 5 % - с локусом κ-цепи t(2;8)(p11;q24). При транслокации c-MYC встраивается в район гена IGH или IGL, при этом оказываясь в области активированных в в-клетках IGH или IGL энхансеров, что приводит к непрерывной экспрессии c-MYC. Также усиление экспрессии c-MYC происходит за счет его структурных повреждений (мутаций), что ведет к изменению регуляции экспрессии и функции продукта гена c-Белок MYC работает как фактор транскрипции и регулирует клеточную пролиферацию, дифференцировку и апоптоз.
В случае ВИЧ-ассоциированной ЛБ ВИЧ, подобно Plasmodium falciparum, стимулирует поликлональную активацию В-клеток и способствует их избыточной пролиферации. ВИЧ инициирует развитие лимфомы опосредованно через цитокиновые нарушения, длительную антигенную стимуляцию и подавление функции иммунологического контроля. Частота возникновения ЛБ в 23 раза выше у лиц, перенесших трансплантацию печени, сердца и почек. Как правило, ЛБ диагностируется у этой категории пациентов через 3-8 лет после проведенной трансплантации.
Epidemiology
У детей ЛБ составляет около 30-50% всех лимфом. Соотношение мальчики:девочки 3-4:1, средний возраст 8 лет [2, 3]. У взрослых ЛБ встречается значительно реже, в 2% случаев всех лимфом. Болеют преимущественно молодые мужчины, соотношение мужчины:женщины - 3:1, средний возраст 25-30 лет.
Classification
Эндемический вариант ЛБ характерен для темнокожих детей-аборигенов экваториальной Африки и мигрантов из Африки в Новую Гвинею. В клинической картине часто наблюдается поражение лицевого скелета: верхней и нижней челюстей, орбиты, а также почек, яичек, яичников, слюнных, молочных желез и центральной нервной системы.
Спорадический вариант ЛБ - типичная ЛБ по морфологическим, иммунофенотипическим и цитогенетическим признакам, возникающая вне эндемичной зоны.
Иммунодефицит-ассоциированный вариант ЛБ - ЛБ, возникающая на фоне иммунодефицитных состояний (у больных ВИЧ-инфекцией, после трансплантации органов, у больных первичными иммунодефицитами). Чаще всего встречается у ВИЧ-инфицированных больных, причем на ранних этапах развития (до снижения сD4+ клеток). Болеют преимущественно мужчины. Частыми проявлениями заболевания являются лимфаденопатия, спленомегалия, вовлечение в опухолевый процесс костного мозга.
Спорадический вариант ЛБ - типичная ЛБ по морфологическим, иммунофенотипическим и цитогенетическим признакам, возникающая вне эндемичной зоны.
Иммунодефицит-ассоциированный вариант ЛБ - ЛБ, возникающая на фоне иммунодефицитных состояний (у больных ВИЧ-инфекцией, после трансплантации органов, у больных первичными иммунодефицитами). Чаще всего встречается у ВИЧ-инфицированных больных, причем на ранних этапах развития (до снижения сD4+ клеток). Болеют преимущественно мужчины. Частыми проявлениями заболевания являются лимфаденопатия, спленомегалия, вовлечение в опухолевый процесс костного мозга.
Symptoms
Клинические проявления ЛБ обусловлены локализацией и объемом опухоли. Практически всегда есть В-симптомы, чаще всего - быстро развивающаяся потеря массы тела (до 10 кг и более за месяц).
Для ЛБ характерна экстранодальная локализация опухоли. Наиболее часто поражаются органы брюшной полости: тонкая кишка (чаще ее терминальный отдел), брыжейка, а также желудок, толстая кишка, брюшина, печень, селезенка. Специфическое поражение костного мозга наблюдается в 25-35% случаев, центральной нервной системы - в 20-25% случаев. Типично вовлечение почек, яичников, яичек, абдоминальных и забрюшинных лимфатических узлов (особенно в илеоцекальной области), реже периферических лимфатических узлов.
В 10-15% случаев ЛБ отмечено вовлечение кольца Вальдейера, слюнных желез, верхней и нижней челюсти, орбиты. Средостение поражается редко.
Для ЛБ характерна экстранодальная локализация опухоли. Наиболее часто поражаются органы брюшной полости: тонкая кишка (чаще ее терминальный отдел), брыжейка, а также желудок, толстая кишка, брюшина, печень, селезенка. Специфическое поражение костного мозга наблюдается в 25-35% случаев, центральной нервной системы - в 20-25% случаев. Типично вовлечение почек, яичников, яичек, абдоминальных и забрюшинных лимфатических узлов (особенно в илеоцекальной области), реже периферических лимфатических узлов.
В 10-15% случаев ЛБ отмечено вовлечение кольца Вальдейера, слюнных желез, верхней и нижней челюсти, орбиты. Средостение поражается редко.
Diagnostics
• Клинические проявления ЛБ обусловлены локализацией и объемом опухоли и могут варьировать от жалоб на локально увеличенные лимфоузлы до различной степени выраженности абдоминального болевого синдрома, в ряде случаев отсутствия самостоятельного мочеиспускания, в ряде случаев сбор анамнеза может быть затруднен в следствие неврологической симптоматики, вызванной нейролейкемией. Практически всегда есть В-симптомы, чаще всего - быстро развивающаяся потеря массы тела (до 10 кг и более за месяц). Анамнез короткий. Как правило, пациент может указать месяц или дату начала развития симптомов.
2,2Физикальное обследование.
• Для ЛБ характерна экстранодальная локализация опухоли. Наиболее часто поражаются органы брюшной полости: тонкая кишка (чаще ее терминальный отдел), брыжейка, а также желудок, толстая кишка, брюшина, печень, селезенка. Специфическое поражение костного мозга наблюдается в 25-35% случаев, центральной нервной системы - в 20-25% случаев. Типично вовлечение почек, яичников, яичек, абдоминальных и забрюшинных лимфатических узлов (особенно в илеоцекальной области), реже периферических лимфатических узлов.
В 10-15% случаев ЛБ отмечено вовлечение кольца Вальдейера, слюнных желез, верхней и нижней челюсти, орбиты. Средостение поражается редко.
Характерным симптомокомплексом при ЛБ является клиника «острого живота» как результат обструктивной кишечной непроходимости, острого аппендицита, желудочно-кишечного кровотечения или перфорации вследствие специфической инфильтрации желудка и/или кишечника. При физикальном осмотре у больного можно обнаружить увеличение живота за счет опухоли и асцита. Рост опухоли происходит стремительно, и в большинстве случаев к моменту госпитализации поражение органов брюшной полости представлено массивным опухолевым конгломератом, с вовлечением несколько внутренних органов. Как правило, больные ЛБ поступают в стационар в тяжелом или крайне тяжелом состоянии, обусловленным большой опухолевой массой, интоксикацией, истощением вплоть до кахексии, электролитными нарушениями. Нередко основной терапевтической проблемой у больных ЛБ на инициальном этапе является прогрессирующая острая почечная недостаточность (ОПН). Наиболее частыми причинами ее развития являются специфическое поражение почек, синдром массивного цитолиза опухоли (СМЦО) и нарушение уродинамики за счет сдавления мочеточников опухолевым конгломератом с развитием постренальной анурии.
2,3Лабораторная.
• Рекомендуется осуществить консультацию оториноларинголога, офтальмолога, невропатолога, гинеколога, уролога, нефролога при наличии показаний.
Уровень убедительности рекомендаций I (уровень достоверности доказательств. A ) [1, 4 - 6].
2,6Стадирование, формулирование диагноза.
Для определения распространенности опухолевого процесса используется стадирование по Murphy S.B. (аналогично - St. Jude).
I стадия:
• одна локальная экстранодальная или нодальная за исключением медиастинальной, абдоминальной или эпидуральной локализации.
II стадия:
• одна экстранодальная опухоль с поражением региональных лимфоузлов;
• две и более групп лимфоузлов по одну сторону диафрагмы;
• две одиночные экстранодальные опухоли с/без поражения региональных лимфоузлов по одну сторону диафрагмы;
• первичная опухоль желудочно-кишечного тракта, локализованная в илеоцекальной области с/без поражения мезентериальных лимфоузлов;
• исключаются медиастинальные, абдоминальные и эпидуральные опухоли.
IIR. Резецированная опухоль (макроскопически полностью удалена);
IINR. Не резецированная опухоль (макроскопически не полностью удалена).
III стадия:
• две одиночные экстранодальные опухоли по обе стороны диафрагмы;
• две и более областей лимфоузлов по обе стороны диафрагмы;
• все первичные внутригрудные опухоли (медиастинальные, плевральные);
• все обширные внутрибрюшные опухоли (нерезектабельные);
• все параспинальные и эпидуральные опухоли вне зависимости от других мест поражения.
IV стадия:
• любая из перечисленных выше локализаций опухоли с инициальным поражением центральной нервной системы и/или костного мозга (бласты <25%) и/или мультифокальным поражением скелета.
Лимфома/лейкоз Беркитта (В-ОЛЛ по типу L 3):
В костном мозге >25% опухолевых клеток [6 - 7].
2,2Физикальное обследование.
• Для ЛБ характерна экстранодальная локализация опухоли. Наиболее часто поражаются органы брюшной полости: тонкая кишка (чаще ее терминальный отдел), брыжейка, а также желудок, толстая кишка, брюшина, печень, селезенка. Специфическое поражение костного мозга наблюдается в 25-35% случаев, центральной нервной системы - в 20-25% случаев. Типично вовлечение почек, яичников, яичек, абдоминальных и забрюшинных лимфатических узлов (особенно в илеоцекальной области), реже периферических лимфатических узлов.
В 10-15% случаев ЛБ отмечено вовлечение кольца Вальдейера, слюнных желез, верхней и нижней челюсти, орбиты. Средостение поражается редко.
Характерным симптомокомплексом при ЛБ является клиника «острого живота» как результат обструктивной кишечной непроходимости, острого аппендицита, желудочно-кишечного кровотечения или перфорации вследствие специфической инфильтрации желудка и/или кишечника. При физикальном осмотре у больного можно обнаружить увеличение живота за счет опухоли и асцита. Рост опухоли происходит стремительно, и в большинстве случаев к моменту госпитализации поражение органов брюшной полости представлено массивным опухолевым конгломератом, с вовлечением несколько внутренних органов. Как правило, больные ЛБ поступают в стационар в тяжелом или крайне тяжелом состоянии, обусловленным большой опухолевой массой, интоксикацией, истощением вплоть до кахексии, электролитными нарушениями. Нередко основной терапевтической проблемой у больных ЛБ на инициальном этапе является прогрессирующая острая почечная недостаточность (ОПН). Наиболее частыми причинами ее развития являются специфическое поражение почек, синдром массивного цитолиза опухоли (СМЦО) и нарушение уродинамики за счет сдавления мочеточников опухолевым конгломератом с развитием постренальной анурии.
2,3Лабораторная.
• Рекомендуется осуществить консультацию оториноларинголога, офтальмолога, невропатолога, гинеколога, уролога, нефролога при наличии показаний.
Уровень убедительности рекомендаций I (уровень достоверности доказательств. A ) [1, 4 - 6].
2,6Стадирование, формулирование диагноза.
Для определения распространенности опухолевого процесса используется стадирование по Murphy S.B. (аналогично - St. Jude).
I стадия:
• одна локальная экстранодальная или нодальная за исключением медиастинальной, абдоминальной или эпидуральной локализации.
II стадия:
• одна экстранодальная опухоль с поражением региональных лимфоузлов;
• две и более групп лимфоузлов по одну сторону диафрагмы;
• две одиночные экстранодальные опухоли с/без поражения региональных лимфоузлов по одну сторону диафрагмы;
• первичная опухоль желудочно-кишечного тракта, локализованная в илеоцекальной области с/без поражения мезентериальных лимфоузлов;
• исключаются медиастинальные, абдоминальные и эпидуральные опухоли.
IIR. Резецированная опухоль (макроскопически полностью удалена);
IINR. Не резецированная опухоль (макроскопически не полностью удалена).
III стадия:
• две одиночные экстранодальные опухоли по обе стороны диафрагмы;
• две и более областей лимфоузлов по обе стороны диафрагмы;
• все первичные внутригрудные опухоли (медиастинальные, плевральные);
• все обширные внутрибрюшные опухоли (нерезектабельные);
• все параспинальные и эпидуральные опухоли вне зависимости от других мест поражения.
IV стадия:
• любая из перечисленных выше локализаций опухоли с инициальным поражением центральной нервной системы и/или костного мозга (бласты <25%) и/или мультифокальным поражением скелета.
Лимфома/лейкоз Беркитта (В-ОЛЛ по типу L 3):
В костном мозге >25% опухолевых клеток [6 - 7].
Treatment
3,1 Определение стратегии лечения.
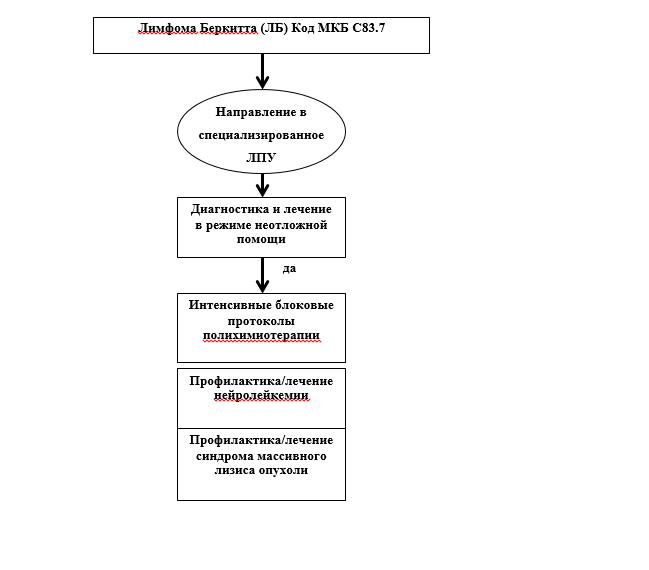
Самая быстро растущая из всех злокачественных новообразований ЛБ отличается высокой химиочувствительностью. У 80-90% больных удается получить длительные полные клинико-гематологические и цитогенетические ремиссии при проведении программ интенсивной высокодозной полихимиотерапии (ПХТ), однако терапия рецидивов остается нерешенной проблемой.Показанием к началу специфической терапии является установленный диагноз ЛБ. Лечение должно быть начато в кратчайшие сроки и проводиться в режиме оказания неотложной медицинской помощи. Необходимо экстренное купирование имеющихся хирургических осложнений (кишечная непроходимость, кровотечения, перфорация), коррекция электролитных нарушений, купирование инфекционных осложнений, болевого синдрома. При наличии ОПН химиотерапия должна быть начата на фоне ежедневных сеансов гемодиализа.
• Рекомендуется проведение короткой импульсной высокоинтенсивной химиотерапии +/- ритуксимаб** (основной метод лечения ЛБ в настоящее время)[1, 4 - 6, 8 - 25].
Уровень убедительности рекомендаций I (уровень достоверности доказательств. A ).
Комментарий. При редко встречающихся локальных стадиях заболевания количество курсов химиотерапии редуцировано в соответствии с протоколами. К факторам плохого прогноза, требующим интенсификации терапии, относят: поражение костного мозга и центральной нервной системы, повышение ЛДГ better 2 верхних границ нормальных значений, поражение почек, костей (мультифокальные очаги), размер опухоли более 10 см Большинство больных ЛБ на момент начала лечения имеют генерализованные стадии заболевания и факторы плохого прогноза.
Основным правилом в терапии ЛБ является соблюдение принципа интервал-дозы , проведение курса в полных дозах с соблюдением межкурсового интервала. За исключением ситуаций развития жизнеугрожающих осложнений не рекомендуется прерывать начатый курс химиотерапии. В исключительных случаях при наличии тяжелых инфекционных осложнений, с которыми не удалось справиться к окончанию межкурсового перерыва, возможно увеличение интервала между курсами.
3,2 Первая линия терапии,.
• Рекомендуется в первой линии лечения применение интенсивных протоколов ПХТ[1, 4 - 6, 8 - 30].Уровень убедительности рекомендаций II (уровень достоверности доказательств. A ).
Комментарий. В разных странах предложены программы риск-адаптированной терапии ЛБ приблизительно одинаковой эффективности, основой которых являются протоколы, разработанные в педиатрической практике в 80-90 гг. XX века.
• Рекомендованы в настоящее время для лечения ЛБ следующие протоколы ПХТ [все. III, в] - R-Hyper-CVAD, ЛБ-М-04+/-R, LMB 95, сODOX-M/IVAC+/-R, R-NHL-BFM 90/95, в-НХЛ 2004 маб. Пациентам старшей возрастной группы без поражения ЦНС (не кандидатам для интенсивной ПХТ) может быть проведено лечение по протоколу R-DA-EPOCH.[1, 4 - 6, 8 - 30].
Уровень убедительности рекомендаций I (уровень достоверности доказательств. A ).
• Рекомендуется терапия ЛБ у пациентов, инфицированных ВИЧ, проводится по аналогичным протоколам на фоне постоянного приема высокоактивной антиретровирусной терапии (ВААРТ). Также могут использоваться программы R-DA-EPOCH, R-CDE, SC-EPOCH-RR, особенно у пациентов с тяжелой сопутствующей патологией.[1, 4 - 6, 8 - 24].
Уровень убедительности рекомендаций I (уровень достоверности доказательств. A ).
• Не рекомендуется в связи с увеличением количества инфекционных осложнений и высоким риском смерти от них ритуксимаб** вводить ВИЧ-инфицированным пациентам при количестве сD4 клеток менее 100/мкл.[1, 4 - 6, 8 - 24].
Уровень убедительности рекомендаций I (уровень достоверности доказательств. A ).
• Рекомендуется обязательная профилактика нейролейкемии путем интратекального введения 3 препаратов (цитарабин** 30 мг, метотрексат** 15 мг, дексаметазон** 4 мг) 1 раз за курс в течение всего периода терапии.[1, 4 - 6, 8 - 30].
Уровень убедительности рекомендаций I (уровень достоверности доказательств. A ).
Лечение нейролейкемии проводят в соответствии со стандартными правилами: люмбальные пункции с введением цитостатиков выполняют 3 раза в неделю до получения 3 нормальных анализов ликвора. На последующих блоках химиотерапии (после санации ликвора) люмбальные пункции с интратекальным введением цитостатиков проводят дважды за курс.
• Рекомендовано всем пациентам с ЛБ установление центрального венозного катетера.[1, 4-6].
Уровень убедительности рекомендаций I (уровень достоверности доказательств. A ).
• Рекомендовано при проведении первого курса терапии к обязательному выполнению профилактика и лечение синдрома массивного цитолиза опухоли: аллопуринол** 10 мг/кг/сут. р.о. + инфузионная терапия 3 л/м2/сут. с защелачиванием р-ром соды 40-80 ммоль/л под контролем диуреза и плановым назначением фуросемида, лабораторным контролем кислотно-основного состояния [1, 5-7].
Уровень убедительности рекомендаций I (уровень достоверности доказательств. A ).
• Рекомендовано при применении высоких доз метотрексата** контроль его элиминации (определение концентрации в сыворотке!) и коррекция дозы кальция фолината.[1, 4-6].
Уровень убедительности рекомендаций I (уровень достоверности доказательств. A ).
Лучевая терапия и поддерживающая терапия больным ЛБ не проводится.
3,3 Вторая линия терапии.
При наличии первично резистентной ЛБ (прогрессирование заболевания, ранний рецидив) эффективность терапии второй и последующих линий минимальна. Рецидивы ЛБ, как правило, развиваются в первые 6-9 мес. после завершения лечения, поздние рецидивы крайне редки.• Рекомендуется, в качестве терапии второй линии к возможному использованию режим R-ICE (при эффективности показано проведение трех курсов), либо других курсов интенсивной иммунохимиотерапии, содержащей препараты, ранее не использовавшиеся у больного. При лечении рецидивов необходима профилактика нейролейкемии по той же программе, что и при лечении первичных больных. [1, 10].
Уровень убедительности рекомендаций IV (уровень достоверности доказательств. D ).
Комментарий. В настоящее время описаны единичные случаи достижения второй ремиссии с последующей эффективной ауто/аллогенной трансплантацией костного мозга. Большинство рецидивов ЛБ инкурабельны.
• Рекомендуется высокодозная химиотерапия и трансплантация костного мозга при достижении 2-й ремиссии. [1, 10].
Уровень убедительности рекомендаций IV (уровень достоверности доказательств. D ).
Комментарий. В первой ремиссии трансплантация костного мозга не показана.
3,4 Оценка результатов лечения.
В процессе терапии перед каждым курсом необходимо оценить локальный и системный ответ на лечение. Выполнение КТ/МРТ показано после каждых 2 курсов терапии с акцентом на области инициального поражения. При вовлечении КМ в дебюте заболевания проводят его исследование после каждого курса до достижения гематологической ремиссии (обычно санация КМ происходит после первого курса). Контроль объемных образований требуется до достижения полной редукции, при сохранении остаточного образования необходимо проведение его биопсии и ПЭТ-исследования. При отсутствии данных за активный опухолевый процесс следует продолжать терапию по протоколу, при диагностике остаточной опухоли - решить вопрос об изменении терапии и проведении трансплантации гемопоэтических стволовых клеток (ТГСК).Rehabilitation and outpatient treatment
Реабилитация пациентов, получавших лечение по поводу лимфопролиферативных заболеваний, остается мало изученной проблемой. Это обусловлено несколькими обстоятельствами:
• велики различия в характеристиках пациентов: дети, молодые пациенты, пожилые и соматически отягощенные пациенты;
• разнообразие применяемых терапевтических подходов с различным профилем токсичности: иммунологическая токсичность при применении антител, миелотоксичность и другие варианты токсичности цитостатиков; кардиотоксичность антрациклинов ;
• необходима индивидуализация при разработке реабилитационных мероприятий для каждого клинического случая. К сожалению, в мировой практике до сегодняшнего дня не было проведено ни одного клинического исследования, специально посвященного вопросам реабилитации пациентов, получивших терапию по поводу лимфопролиферативного заболевания.
Это позволяет обоснованно считать, что в настоящее время единственной возможной рекомендацией остается симптоматическое и патогенетическое лечение нежелательных явлений, развившихся в результате противоопухолевой терапии. Этим вопросам посвящены отдельные разделы данных рекомендаций.
• велики различия в характеристиках пациентов: дети, молодые пациенты, пожилые и соматически отягощенные пациенты;
• разнообразие применяемых терапевтических подходов с различным профилем токсичности: иммунологическая токсичность при применении антител, миелотоксичность и другие варианты токсичности цитостатиков; кардиотоксичность антрациклинов ;
• необходима индивидуализация при разработке реабилитационных мероприятий для каждого клинического случая. К сожалению, в мировой практике до сегодняшнего дня не было проведено ни одного клинического исследования, специально посвященного вопросам реабилитации пациентов, получивших терапию по поводу лимфопролиферативного заболевания.
Это позволяет обоснованно считать, что в настоящее время единственной возможной рекомендацией остается симптоматическое и патогенетическое лечение нежелательных явлений, развившихся в результате противоопухолевой терапии. Этим вопросам посвящены отдельные разделы данных рекомендаций.
Prevention
Методов профилактики лимфомы Беркитта в настоящее время не существует, поскольку неизвестен этиологический фактор, ведущий к развитию заболевания. Диспансерное наблюдение гематологом или онкологом осуществляется в период лечения и после достижения ремиссии лимфомы.
Динамическое наблюдение осуществляется через месяц после окончания лечения для подтверждения состояния ремиссии необходимо полное клинико-лабораторное обследование, включающее КТ/МРТ зон исходного поражения, исследование костного мозга в случае его инициального поражения.
Динамическое наблюдение проводится в первый год 1 раз в 3 месяца, во 2-3 годы - 2 раза в год, далее 1 раз в год до 5 лет или по клиническим показаниям. Необходимо выполнение клинического и биохимического анализов крови, КТ грудной, брюшной полостей и малого таза.
Динамическое наблюдение осуществляется через месяц после окончания лечения для подтверждения состояния ремиссии необходимо полное клинико-лабораторное обследование, включающее КТ/МРТ зон исходного поражения, исследование костного мозга в случае его инициального поражения.
Динамическое наблюдение проводится в первый год 1 раз в 3 месяца, во 2-3 годы - 2 раза в год, далее 1 раз в год до 5 лет или по клиническим показаниям. Необходимо выполнение клинического и биохимического анализов крови, КТ грудной, брюшной полостей и малого таза.
Additional information
6,1 Ошибки и необоснованные назначения.
• Не рекомендуется выполнение пункции лимфоузла (очага поражения)Уровень убедительности рекомендаций IV (уровень достоверности доказательств. D ).Комментарии. Диагноз лимфомы не может быть установлен по пунктату, без полноценного гистологического и гистохимического исследования.
• Не рекомендуется выполнение радикальных операций, включающих удаление одного или нескольких органов, вовлеченных в опухолевый процесс (удаление яичников, селезенки, поджелудочной железы, желудка, почки, матки) в отсутствие показаний.Уровень убедительности рекомендаций IV (уровень достоверности доказательств. D ).
Комментарий. Подобные операции могут приводить к кахексии больных, нарушению жизненно важных функций.
6,2 Лимфомы и беременность.
• Рекомендуется со всеми больными детородного возраста обоих полов обсуждать вопрос о возможности криоконсервации спермы или ткани яичника перед началом терапииУровень убедительности рекомендаций I (уровень достоверности доказательств. A ).Комментарии. Химиотерапия и облучение области таза могут привести к необратимой стерильности пациента.
• Рекомендуется с женщинами детородного возраста обсуждать вопрос о необходимости гормональной защиты от беременности, а также о методах возможной гормональной защиты яичников при проведении интенсивных программ лечения.Уровень убедительности рекомендаций I (уровень достоверности доказательств. A ).
Forecast
Самая быстро растущая из всех злокачественных новообразований ЛБ отличается высокой химиочувствительностью. У 80-90% больных удается получить длительные полные клинико-гематологические и цитогенетические ремиссии при проведении программ интенсивной высокодозной полихимиотерапии (ПХТ), однако терапия рецидивов остается нерешенной проблемой.
Criteria for assessing the quality of medical care
| № | Критерии качества | Уровень достоверности доказательств | Уровень убедительности рекомендаций |
| 1 | Выполнена биопсия лимфоузла (очага поражения) с цитологическим, морфологическим, иммуногистохимическим исследованиями | I | A |
| 2 | Выполнен клинический анализ крови (гемоглобин, эритроциты, тромбоциты, лейкоциты, лейкоцитарная формула) | I | A |
| 3 | Выполнен биохимический анализ крови (общий белок, альбумин, мочевина, креатинин, мочевая кислота, АЛТ, АСТ, общий и прямой билирубин, холестерин, ЛДГ, щелочная фосфатаза, электролиты, кальций) | I | A |
| 4 | Выполнено КТ/УЗИ/МРТ грудной полости, брюшной полости, малого таза, дополнительных очагов поражения | I | A |
| 5 | Выполнена трепанобиопсия с гистологическим исследованием костного мозга | I | A |
| 6 | Выполнено ЭКГ | I | A |
| 7 | Выполнена Коагулограмма | I | A |
References
• Барях Е.А. Кравченко С. Обухова Т.Н. и соавт. Лимфома Беркитта: клиника, диагностика, лечение. Клиническая онкогематология. Фундаментальные исследования и клиническая практика. 2009; 2 (2): 137-146.
• Самочатова Е.В. Алейникова О.В. Беликова Л.Ю. Неходжкинские лимфомы у детей: клиническая характеристика, возможности диагностики и терапии; по данным клиник России и Беларуссии. Гематол. Трансфузиол. 2001; 46 (1): 3-10.
• Тюкалова Н.P. Федоpова А.С. Шумилова И.В. Pумянцев А.Г. Неходжкинские лимфомы у детей: клиническая хаpактеpистика, возможности диагностики и теpапии; по данным клиник Pоссии и Белаpуси . Гематология и трансфузиология. 2002; 3: 58.
• вernstein J.I.; сoleman с.N. Strickler J.G. et al. сombineted modality therapy for adult with small noncleaved cell lymphoma (Burkitt’s and вurkitt-like type). J сlin Oncol. 1986; 4: 847-858. вowman W. Shuster J.; сook в. et al. Improved survival for children with в- cell acute lymphoblastic leukemia and stage IV small noncleaved-cell lymphoma: a Pediatric Oncology group study. J сlin Oncol, 1996; 14: 1252-1261.
• сoiffier в.; вryon P.A. French M. et al. Intensive chemotherapy in agressive lymphomas: Updated results of LNH-80 protocol and prognostic factors affecting response and survival. вlood. 1987; 70: 1394.
• вowman W. Shuster J.; сook в. et al. Improved survival for children with в- cell acute lymphoblastic leukemia and stage IV small noncleaved-cell lymphoma: a Pediatric Oncology group study. J сlin Oncol, 1996; 14: 1252-1261.
• Fenaux P. Lai J.L. Miaux O. et al. вurkitt acute leukemia (L3 ALL) in adults: a report of 18 cases. вr J Haematol. 1989; 71: 371-376.
• Dunleavy K. Pittaluga S. Shovlin M. et al. Low-intensity therapy in adults with вurkitt s lymphoma. N Engl J Med., 2013; 369 (20): 1915-25.
• Finlay J. Trigg M. Link M. et al. Poor-risk non-lymphoblastic lymphoma of childhood: result of an intensive pilot study. Med Pediatr Oncol. 1989; 17: 29.
• Griffin T.C. Weitzman S. Weinstein H. et al. сhildren s Oncology Group. A study of rituximab and ifosfamide, carboplatin, and etoposide chemotherapy in children with recurrent/refractory в-cell (CD20+) non-Hodgkin lymphoma and mature в-cell acute lymphoblastic leukemia: a report from the сhildren s Oncology Group. Pediatr вlood сancer. 2009; 52(2): 177-81.
• Hoelther D. Thiel E. et al. Improved outcome in adult в-cell acute lymphoblastic leukemia. вlood. 1996; 87: 495-508.
• Lacasce A. Howard O. Lib S. et al. Modified magrath regimens for adults with вurkitt and вurkitt-like lymphomas: preserved efficacy with decreased toxicity. Leuk Lymphoma, 2004; 45 (4): 761-7.
• Link M.P. Shuster J.J. Donaldson S.S. et al. Treatment of children and young adults with early-stage non-Hodgkin lymphoma. N Engl J Med. 1997; 337: 1259.
• Lopez J.M. Hagemeister F.B. MgLaughlin P. et al. Small noncleaved cell lymphoma in adult: superior results for stage I-III disease. J сlin Oncol, 1990; 8: 615-622.
• Magrath I. Adde M. Shad A. et al. Adult and children with small noncleaved-cell lymphoma have a similar excellent outcome when treated with the same chemotherapy regimen. J сlin Oncol. 1996; 14: 925-934.
• Mead G.M.; вarrans S.L. Qian W. et al. A prospective clinicopathologic study of dose-modified сODOX-M/IVAC in patients with sporadic вurkitt lymphoma defined using cytogenetic and immunophenotypic criteria (MRC/NCRI LY10 trial). вlood. 2008;12:2248-2260.
• Murphy S.; вowman W. Abromovitch M. et al. Results of treatment of advanced-stage вurkitt’s lymphoma and в-cell (S Ig+) acute lymphoblastic leukemia with high-dose fractionated cyclophosphamide and coordinated high-dose methotrexate and cytarabine. J сlin Oncol. 1986; 4: 1732-1739.
• Patte с. Auperin A. Michon J. et al. The Société Française d Oncologie Pédiatrique LMB89 protocol: highly effective multiagent chemotherapy tailored to the tumor burden and initial response in 561 unselected children with в-cell lymphomas and L3 leukemia. вlood. 2001; 97: 3370-3379.
• Patte с.; вernard A. Hartmann O. et al. High-dose metotrexate and continuous infusion Ara-C in childhood NHL. Pediatr Hematol Oncol. 1986; 3: 11-18.
• Patte с. Philip T. Rodary с. et al. High survival rate in advanced-stage в-cell lymphomas and leukemias without сNS involvement with a short intensive polychemotherapy: results from the French Pediatric Oncology Society of a randomized trial of 216 children. J сlin Oncol. 1991; 9: 123-132.
• Patte с. Philip T. Rodary с. et al. Improved survival rate in children with stage III-IV в-cell non-Hodgkin lymphoma and leukemia using multiagent chemotherapy: results of a study of 114 children from the French Pediatric Oncology Society. J сlin Oncol. 1986; 8: 1219-1226.
• Reiter A. Schrappe M. Ludwig W.D; et al. Favorable outcome of в- cell acute lymphoblastic leukemia in childhood: a report of three consecutive studies of the вFM group. вlood. 1992; 90: 2471-2478.
• Reiter A. Schrappe M. Tiemann M. et al. Improved treatment results in childhood в-cell neoplasms with tailored intensification of therapy: a report of the вerlin-Frankfurt-Munster Group Trial NHL-BFM-90. вlood. 1999; 94 (10): 3294-3306.
• вarnes J.A. Lacasce A.S. Feng Y. et al. Evaluation of the addition of rituximab to сODOX-M/IVAC for вurkitt s lymphoma: a retrospective analysis. Ann Oncol., 2011; 22 (8): 1859-64.
• самочатова Е.В. Островская А.В. Карачунский А.И. Значение верификации варианта неходжкинских лимфом у детей для эффективности лечения по современным протоколам Гематол. и трасфузиол. 2000; 6: 9-14.
• Schwenn M.; вlattner S. Lynch E. Weinstein H. HiC-COM: a 2-month intensive chemotherapy regimen for children with stage III and IV вurkitt’s lymphoma and в-cell acute lymphoblastic leukemia. J сlin Oncol. 1991; 9: 133-138.
• Soussain с. Patte с. Ostronoff M. et al. Small noncleaved cell lymphoma and leukemia in adult. A retrospective study of 65 adults treated with the LMB pediatric protocols. вlood. 1995; 85: 664-674.
• Spreafico F. Massimino M. Luksch R; et al. Intensive, very short-term chemotherapy for advanced вurkitt’s lymphoma in children. J сlin Oncol. 2002; 20 (12): 2783-2788.
• Thomas D.; сortes J. O’Brien S. et al. Hyper-CVAD program in вurkitt’s type adult acute lymphoblastic leukemia. J сlin Oncol. 1999;17:2461-2470.
• Thomas D. Faderl S. O Brien S. et al. сhemoimmunotherapy with hyper-CVAD plus rituximab for the treatment of adult вurkitt and вurkitt-type lymphoma or acute lymphoblastic leukemia. сancer, 2006; 106(7): 1569-80.
• Самочатова Е.В. Алейникова О.В. Беликова Л.Ю. Неходжкинские лимфомы у детей: клиническая характеристика, возможности диагностики и терапии; по данным клиник России и Беларуссии. Гематол. Трансфузиол. 2001; 46 (1): 3-10.
• Тюкалова Н.P. Федоpова А.С. Шумилова И.В. Pумянцев А.Г. Неходжкинские лимфомы у детей: клиническая хаpактеpистика, возможности диагностики и теpапии; по данным клиник Pоссии и Белаpуси . Гематология и трансфузиология. 2002; 3: 58.
• вernstein J.I.; сoleman с.N. Strickler J.G. et al. сombineted modality therapy for adult with small noncleaved cell lymphoma (Burkitt’s and вurkitt-like type). J сlin Oncol. 1986; 4: 847-858. вowman W. Shuster J.; сook в. et al. Improved survival for children with в- cell acute lymphoblastic leukemia and stage IV small noncleaved-cell lymphoma: a Pediatric Oncology group study. J сlin Oncol, 1996; 14: 1252-1261.
• сoiffier в.; вryon P.A. French M. et al. Intensive chemotherapy in agressive lymphomas: Updated results of LNH-80 protocol and prognostic factors affecting response and survival. вlood. 1987; 70: 1394.
• вowman W. Shuster J.; сook в. et al. Improved survival for children with в- cell acute lymphoblastic leukemia and stage IV small noncleaved-cell lymphoma: a Pediatric Oncology group study. J сlin Oncol, 1996; 14: 1252-1261.
• Fenaux P. Lai J.L. Miaux O. et al. вurkitt acute leukemia (L3 ALL) in adults: a report of 18 cases. вr J Haematol. 1989; 71: 371-376.
• Dunleavy K. Pittaluga S. Shovlin M. et al. Low-intensity therapy in adults with вurkitt s lymphoma. N Engl J Med., 2013; 369 (20): 1915-25.
• Finlay J. Trigg M. Link M. et al. Poor-risk non-lymphoblastic lymphoma of childhood: result of an intensive pilot study. Med Pediatr Oncol. 1989; 17: 29.
• Griffin T.C. Weitzman S. Weinstein H. et al. сhildren s Oncology Group. A study of rituximab and ifosfamide, carboplatin, and etoposide chemotherapy in children with recurrent/refractory в-cell (CD20+) non-Hodgkin lymphoma and mature в-cell acute lymphoblastic leukemia: a report from the сhildren s Oncology Group. Pediatr вlood сancer. 2009; 52(2): 177-81.
• Hoelther D. Thiel E. et al. Improved outcome in adult в-cell acute lymphoblastic leukemia. вlood. 1996; 87: 495-508.
• Lacasce A. Howard O. Lib S. et al. Modified magrath regimens for adults with вurkitt and вurkitt-like lymphomas: preserved efficacy with decreased toxicity. Leuk Lymphoma, 2004; 45 (4): 761-7.
• Link M.P. Shuster J.J. Donaldson S.S. et al. Treatment of children and young adults with early-stage non-Hodgkin lymphoma. N Engl J Med. 1997; 337: 1259.
• Lopez J.M. Hagemeister F.B. MgLaughlin P. et al. Small noncleaved cell lymphoma in adult: superior results for stage I-III disease. J сlin Oncol, 1990; 8: 615-622.
• Magrath I. Adde M. Shad A. et al. Adult and children with small noncleaved-cell lymphoma have a similar excellent outcome when treated with the same chemotherapy regimen. J сlin Oncol. 1996; 14: 925-934.
• Mead G.M.; вarrans S.L. Qian W. et al. A prospective clinicopathologic study of dose-modified сODOX-M/IVAC in patients with sporadic вurkitt lymphoma defined using cytogenetic and immunophenotypic criteria (MRC/NCRI LY10 trial). вlood. 2008;12:2248-2260.
• Murphy S.; вowman W. Abromovitch M. et al. Results of treatment of advanced-stage вurkitt’s lymphoma and в-cell (S Ig+) acute lymphoblastic leukemia with high-dose fractionated cyclophosphamide and coordinated high-dose methotrexate and cytarabine. J сlin Oncol. 1986; 4: 1732-1739.
• Patte с. Auperin A. Michon J. et al. The Société Française d Oncologie Pédiatrique LMB89 protocol: highly effective multiagent chemotherapy tailored to the tumor burden and initial response in 561 unselected children with в-cell lymphomas and L3 leukemia. вlood. 2001; 97: 3370-3379.
• Patte с.; вernard A. Hartmann O. et al. High-dose metotrexate and continuous infusion Ara-C in childhood NHL. Pediatr Hematol Oncol. 1986; 3: 11-18.
• Patte с. Philip T. Rodary с. et al. High survival rate in advanced-stage в-cell lymphomas and leukemias without сNS involvement with a short intensive polychemotherapy: results from the French Pediatric Oncology Society of a randomized trial of 216 children. J сlin Oncol. 1991; 9: 123-132.
• Patte с. Philip T. Rodary с. et al. Improved survival rate in children with stage III-IV в-cell non-Hodgkin lymphoma and leukemia using multiagent chemotherapy: results of a study of 114 children from the French Pediatric Oncology Society. J сlin Oncol. 1986; 8: 1219-1226.
• Reiter A. Schrappe M. Ludwig W.D; et al. Favorable outcome of в- cell acute lymphoblastic leukemia in childhood: a report of three consecutive studies of the вFM group. вlood. 1992; 90: 2471-2478.
• Reiter A. Schrappe M. Tiemann M. et al. Improved treatment results in childhood в-cell neoplasms with tailored intensification of therapy: a report of the вerlin-Frankfurt-Munster Group Trial NHL-BFM-90. вlood. 1999; 94 (10): 3294-3306.
• вarnes J.A. Lacasce A.S. Feng Y. et al. Evaluation of the addition of rituximab to сODOX-M/IVAC for вurkitt s lymphoma: a retrospective analysis. Ann Oncol., 2011; 22 (8): 1859-64.
• самочатова Е.В. Островская А.В. Карачунский А.И. Значение верификации варианта неходжкинских лимфом у детей для эффективности лечения по современным протоколам Гематол. и трасфузиол. 2000; 6: 9-14.
• Schwenn M.; вlattner S. Lynch E. Weinstein H. HiC-COM: a 2-month intensive chemotherapy regimen for children with stage III and IV вurkitt’s lymphoma and в-cell acute lymphoblastic leukemia. J сlin Oncol. 1991; 9: 133-138.
• Soussain с. Patte с. Ostronoff M. et al. Small noncleaved cell lymphoma and leukemia in adult. A retrospective study of 65 adults treated with the LMB pediatric protocols. вlood. 1995; 85: 664-674.
• Spreafico F. Massimino M. Luksch R; et al. Intensive, very short-term chemotherapy for advanced вurkitt’s lymphoma in children. J сlin Oncol. 2002; 20 (12): 2783-2788.
• Thomas D.; сortes J. O’Brien S. et al. Hyper-CVAD program in вurkitt’s type adult acute lymphoblastic leukemia. J сlin Oncol. 1999;17:2461-2470.
• Thomas D. Faderl S. O Brien S. et al. сhemoimmunotherapy with hyper-CVAD plus rituximab for the treatment of adult вurkitt and вurkitt-type lymphoma or acute lymphoblastic leukemia. сancer, 2006; 106(7): 1569-80.
Appendices
Приложение А1.
Состав рабочей группы.• Аль-Ради Любовь Саттаровна. Кандидат медицинских наук, врач-гематолог, старший научный сотрудник ФГБУ Гематологический научный центр МЗ РФ, г. Москва.
• Бабичева Лали Галимовна. Кандидат медицинских наук, врач-онкогематолог, доцент кафедры онкологии ГБОУ ДПО Российская медицинская академия последипломного образования , Москва.
• Байков Вадим Валентинович. Доктор медицинских наук, профессор кафедры патологической анатомии, заведующий лабораторией патоморфологии НИИ детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой Первого СПбГМУ им. акад. И.П. Павлова, Санкт-Петербург.
• Барях Елена Александровна. Кандидат медицинских наук, врач-гематолог, ассистент кафедры гематологии ГБОУ ДПО Российская медицинская академия последипломного образования , Москва.
• Бялик Татьяна Евгеньевна. Кандидат медицинских наук, врач-онкогематолог, ассистент кафедры онкологии Первого МГМУ им. И.М. Сеченова, Москва.
• Виноградова Юлия Николаевна. Доктор медицинских наук, врач-радиотерапевт, ведущий научный сотрудник отделения лучевой терапии системных заболеваний, возглавляет кафедру радиологии и хирургических технологий ФГБУ «Российский научный центр радиологии и хирургических технологий» МЗ РФ, Санкт-Петербург.
• Воробьев Владимир Иванович. Кандидат медицинских наук, врач-гематолог, заведующий блоком интенсивной терапии гематологического отделения ГБУЗ Городская клиническая больница им. С.П. Боткина» Департамента здравоохранения города Москвы.
• Демина Елена Андреевна. Доктор медицинских наук, профессор, врач-онкогематолог, ведущий научный сотрудник отделения химиотерапии гемобластозов ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» Минздрава России, г. Москва.
• Зарицкий Андрей Юрьевич. Доктор медицинских наук, профессор, врач-онкогематолог, директор института гематологии ФМИЦ им. В. А. Алмазова, Санкт-Петербург.
• Ильин Николай Васильевич. Доктор медицинских наук, профессор, врач-радиотерапевт высшей категории, руководитель радиотерапевтического отделения № 1 ФГБУ Российский научный центр радиологии и хирургических технологий МЗ РФ, Санкт-Петербург.
• Вотякова Ольга Михайловна. Кандидат медицинских наук, врач-онкогематолог, старший научный сотрудник отделения химиотерапии гемобластозов НИИ КО ФГБУ РОНЦ им. Н.Н. Блохина Минздрава России, Москва.
• Горенкова Лилия Гамилевна. Кандидат медицинских наук, врач-гематолог ФГБУ Гематологический научный центр Министерства здравоохранения и социального развития Российской Федерации, г. Москва.
• Капланов Камиль Даниялович. Кандидат медицинских наук, врач-гематолог, заведующий гематологическим отделением Волгоградского областного клинического онкологического диспансера (ВОКОД), Волгоград.
• Ковригина Алла Михайловна. Доктор биологических наук, врач-патоморфолог, профессор кафедры патологической анатомии, цитологии и молекулярной патологии ИПК ФМБА РФ, заведующая патологоанатомическим отделением ФГБУ «Гематологический научный центр» МЗ РФ, Москва.
• Константинова Татьяна Семеновна. Кандидат медицинских наук, врач-гематолог, заведующая гематологическим отделением Свердловской областной клинической больницы №1, ассистент кафедры пропедевтики внутренних болезней Уральской государственной медицинской академии, г. Екатеринбург.
• Кравченко Сергей Кириллович. Кандидат медицинских наук, врач-гематолог, доцент, заведующий научно-клиническим отделением химиотерапии гемобластозов ФГБУ Гематологический научный центр МЗ РФ, ассистент кафедры гематологии и трансфузиологии ГБОУ ДПО РМАПО, г. Москва.
• Криволапов Юрий Александрович. Доктор медицинских наук, профессор, врач-патологоанатом, заведующий отделением клинической молекулярной морфологии Северо-Западного государственного медицинского университета им. И. И. Мечникова, Санкт-Петербург.
• Кузьмин Алексей Александрович. Врач-онколог высшей квалификационной категории, заведующий отделением химиотерапии №2 ГАУЗ Республиканский клинический онкологический диспансер МЗ РТ , г. Казань.
• Луговская Светлана Алексеевна. Доктор медицинских наук, профессор кафедры клинической лабораторной диагностики РМАПО МЗ РФ, г. Москва.
• Мационис Александр Эдуардович. Доктор медицинских наук, академик РАЕН, врач-патоморфолог высшей категории, заведующий лабораторией иммуноморфологии ГБУ Ростовской области «Патолого-анатомическое бюро», Ростов-на-Дону.
• Менделеева Лариса Павловна. Доктор медицинских наук, профессор, заместитель Генерального директора Гематологического научного центра МЗ РФ по научной работе и инновациям, г. Москва.
• Михайлова Наталья Борисовна. Доктор медицинских наук, врач-гематолог, руководитель отдела клинической онкологии (химиотерапии) НИИ детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой, Санкт-Петербург.
• Мухортова Ольга Валентиновна. Доктор медицинских наук, врач-радилог высшей категории, старший научный сотрудник Отдела ядерной диагностики (ПЭТ-центр) на базе Научного центра сердечно-сосудистой хирургии им. А.Н. Бакулева, Москва.
• Мякова Наталья Валерьевна. Доктор медицинских наук, профессор, заведующая отделением онкогематологии Центр детской гематологии им. Дмитрия Рогачёва (ФНКЦ ДГОИ).
• Никитин Евгений Александрович. Доктор медицинских наук, профессор, врач-гематолог, заведующий дневным стационаром гематологии, онкологии и химиотерапии городского гематологического центра ГБУЗ ГКБ им. С.П. Боткина ДЗ г. Москвы.
• Османов Евгений Александрович. Профессор, доктор медицинских наук, врач высшей квалификационной категории, заведующий отделением химиотерапии гемобластозов РНЦ РАМН, Москва.
• Поддубная Ирина Владимировна. Член-корреспондент РАН, заслуженный деятель образования РФ, доктор медицинских наук, профессор, заведующая кафедрой онкологии, проректор по учебной работе и международному сотрудничеству ГБОУ ДПО «Российская медицинская академия последипломного образования»( РМАПО) МЗ РФ, г. Москва.
• Поспелова Татьяна Ивановна. Доктор медицинских наук, врач-гематолог, профессор, заведующая кафедрой терапии, гематологии и трансфузиологии Новосибирского государственного медицинского университета, руководитель Городского гематологического центра, г. Новосибирск.
• Птушкин Вадим Вадимович. Доктор медицинских наук, врач-гематолог, заместитель главного врача ГКБ им С.П. Боткина по гематологии, профессор кафедры онкологии, гематологии и лучевой терапии РНИМУ им. Н. И. Пирогова, Главный внештатный специалист гематолог- трансфузиолог Департамента здравоохранения города Москвы.
• Самойлова Ольга Сергеевна. Кандидат медицинских наук, врач-гематолог, заведующая гематологическим отделением Нижегородской областной клинической больницы им. Н.А. Семашко, Нижний Новгород.
• Самочатова Елена Владимировна. Доктор медицинских наук, профессор, заведующая отделом клинических исследований в ФГБУ «ФНКЦ детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева» МЗ РФ, г. Москва.
• Сотников Владимир Михайлович. Доктор медицинских наук, профессор, врач-радиолог, врач-онколог высшей категории, главный научный сотрудник, заведующий лабораторией лучевой терапии научно−исследовательского отдела инновационных технологий в радиотерапии и химиолучевого лечения злокачественных новообразований ФГБУ РНЦРР МЗ РФ, Москва.
• Стадник Елена Александровна. Кандидат медицинских наук, врач-гематолог, доцент кафедры факультетской терапии СПбГМУ им. И. П. Павлова, старший научный сотрудник НИЛ онкогематологии ФГБУ «СЗФМИЦ им. В.А. Алмазова» МЗ РФ, г. Санкт-Петербург.
• Стефанов Дмитрий Николаевич. Доктор медицинских наук. Старший медицинский менеджер, ООО «ТС Онколоджи».
• Трофимова Оксана Петровна. Доктор медицинских наук, врач-радиолог, ведущий научный сотрудник радиологического отделения РОНЦ им.Н.Н. Блохина, Москва.
• Тумян Гаяне Сергеевна. Доктор медицинских наук, врач-онколог, ведущий научный сотрудник отделения химиотерапии гемобластозов ФГБУ «РОНЦ им. Н.Н. Блохина», профессор кафедры онкологии Российской медицинской академии последипломного образования, Москва.
Приложение А2.
Методология разработки клинических рекомендаций.На протяжении многих лет врачи и организаторы здравоохранения всего мира стараются облегчить и оптимизировать свою работу посредством разработок рекомендаций по лечению отдельных заболеваний, которые составлены ведущими специалистами данной области медицины и учитывают как все последние достижения медицинской науки, так и практические особенности здравоохранения данного региона. Подобные рекомендации создаются на различных уровнях, начиная от международных рекомендаций, написанных объединенными группами экспертов разных стран, заканчивая локальными, действующими в отдельных клиниках. Наличие подобных рекомендаций способствует облегчению выбора тактики лечения практическими врачами, обеспечивает их полной и современной информацией о преимуществах и ограничениях различных методов лечения, а также позволяет организаторам здравоохранения лучше оценивать возможные объемы необходимого лечения.
В 2007 г. была создана первая в России рабочая группа по написанию клинических рекомендаций по лечению больных хроническим лимфолейкозом. Впервые эти рекомендации были изданы в 2008 г., в 2010-2011 гг. они были модернизированы и переизданы. На этом этапе к работе над их написанием был приглашен международный эксперт, профессор M. Hallek (Германия).
Учитывая этот успешный опыт создания клинических рекомендаций, а также нарастающую потребность практикующих врачей в аналогичном документе, касающемся других нозологий, Российское профессиональное общество онкогематологов под руководством проф. И.В. Поддубной и Национальное гематологическое общество под руководством проф. В.Г. Савченко выступили с инициативой написания Российских клинических рекомендаций по диагностике и лечению злокачественных лимфопролиферативных заболеваний. Данное начинание было поддержано проф. F. сavalli (Швейцария), который согласился стать третьим руководителем проекта.
Первая версия Российских клинических рекомендаций по диагностике и лечению лимфопролиферативных заболеваний была подготовлена в 2012-2013 гг., и в 2013 г. была опубликована в журнале «Современная онкология», а также на ряде профессиональных медицинских сайтов, в том числе на сайтах обоих обществ, и незамедлительно получила широкое распространение среди практических врачей-онкологов и гематологов страны.
Динамичное развитие современной онкогематологии требует от специалистов постоянного обновления своих знаний и внедрения новых методов диагностики и лечения в практику. В этой связи клинические рекомендации должны постоянно совершенствоваться, развиваться и обновляться в соответствии с научными открытиями и новыми требованиями специалистов, непосредственно занимающихся лечением больных. Учитывая эти требования, рабочая группа по подготовке рекомендаций приняла решение о регулярном обновлении данного документа 1 раз в 2 года.
Вторая версия Российских клинических рекомендаций по диагностике и лечению злокачественных лимфопролиферативных заболеваний была опубликована в 2014 г. Были добавлены последние данные о возможностях диагностики и лечения лимфом, хронического лимфолейкоза и множественной миеломы, а также добавлены новые разделы и приложения. Обсуждение обновлений состоялось в рамках II Конгресса гематологов России.
В данное издание вошла третья версия рекомендаций, подготовленная специалистами в 2015-2016 гг. Все основные разделы рекомендаций были обновлены с учетом последних научных достижений в данной области, а также пожеланий практических онкологов и гематологов, имевших возможность использовать первые издания рекомендаций начиная с 2013 г. В рекомендации добавлены новые классификации и прогностические системы, разработанные в последние годы, а также лекарственные препараты, зарегистрированные или планируемые к регистрации в Российской федерации в 2015-2016 гг. Значительно расширен круг специалистов смежных областей, участвовавших в написании разделов рекомендаций по диагностике и лечению пациентов, у которых помимо лимфопролиферативной патологии диагностируются иные тяжелые заболевания, влияющие на терапевтическую тактику. Обновления рекомендаций были широко и подробно обсуждены специалистами в рамках трех крупнейших мероприятий, проводимых в данной области: Форума экспертов по вопросам диагностики и лечения злокачественных лимфопролиферативных заболеваний «Лимфорум», ежегодной Российской конференции с международным участием «Злокачественные лимфомы», а также III Конгресса гематологов России.
Целевая аудитория клинических рекомендаций:
• Врач-гематолог 31,08,29 - гематология.
• Врач-онколог 31,08,57 - онкология.
В настоящих клинических рекомендациях в квадратных скобках приведены уровни доказательности рекомендаций, в соответствии со шкалами, разработанными Американским обществом клинической онкологии (ASCO) и Европейским обществом медицинской онкологии (ESMO).
Таблица 4.
Уровни и степени доказательности.
| Уровень доказательности | Тип доказательности |
| I | Как минимум одно крупное рандомизированное контролируемое исследование высокого качества (с низкой вороятностью ошибок) или мета-анализ гомогенных рандомизированных исследований высокого качества |
| II | Неблольшие рандомизированные исследования или крупные рандомизированные исследования с высокой вероятностью ошибок. Мета-анализ подобных исследований или мета-анализ гетерогенных исследований |
| III | Проспективные когортные исследования |
| IV | Ретроспективные когортные исследования или исследования «случай-контроль» |
| V | Исследования без контрольной группы, отдельные случаи, мнение экспертов |
Таблица 5.
| Степень | Градация |
| A | Достоверные данные о высокой клинической эффективности, настоятельно рекомендуется |
| в | Достоверные или убедительные данные об умеренной клинической эффективности, рекомендуется |
| с | Недостоверные данные об эффективности, которая не перевешивает риск или недостатки лечения (нежелательные явления, стоимость ), может применяться как один из вариантов |
Индикаторы доброкачественной клинической практики ( Good Practice Points. GPPs ):
Доброкачественная практика рекомендаций основывается на квалификации и клиническом опыте авторского коллектива.
Методология валидизации рекомендаций.
Методы валидизации рекомендаций:
• Внешняя экспертная оценка;
• Внутренняя экспертная оценка.
Описание методики валидизации рекомендаций:
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать, насколько качественно интерпретированы доказательства и разработаны рекомендации. Также была проведена экспертная оценка изложения рекомендаций и их доступности для понимания.
Рекомендации обсуждены и одобрены ведущими специалистами профильных Федеральных центров РФ и практическими врачами. Проект клинических рекомендаций был рассмотрен на совещаниях рабочей группы в 2015-2016 гг., на Форуме экспертов по вопросам диагностики и лечения злокачественных лимфопролиферативных заболеваний «Лимфорум», ежегодной Российской конференции с международным участием «Злокачественные лимфомы», а также III Конгресса гематологов России.
Окончательная редакция:
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами авторского коллектива, которые пришли к заключению, что все существенные замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке сведен к минимуму.
Клинические рекомендации утверждены на XIII Российской конференции с международным участием «Злокачественные лимфомы» в 2016.
Приложение А3.
Связанные документы.КР400. Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи.
Приложение В.
Информация для пациентов.Лимфома Беркитта - это агрессивная В-клеточная опухоль лимфоидного происхождения. Несмотря на тяжелое состояние больного в дебюте заболевания, данная опухоль является потенциально курабельной. При применении высокодозной импульсной терапии 5-летняя общая выживаемость составила 85%, а 5-летняя безрецидивная выживаемость - 95%. Пациент должен четко выполнять все предписания врача относительно времени и сроков выполнения диагностических процедур, а также курсов химиотерапии. Обязательно должен сообщить о нежелательных явлениях, если таковые имеются, во время прохождения лечения.
Приложение Г.
Year of updating the information
2017.
Related diseases
Related clinical guidelines
- Агрессивные нефолликулярные лимфомы - диффузная крупноклеточная В-клеточная лимфома, первичная медиастинальная В-клеточная лимфома, лимфома Беркитта
- ВИЧ-инфекция у взрослых: лимфомы
- Неходжкинские лимфомы у детей
- Лимфомы у взрослых: Гепатиты В и С
- Острые лимфобластные лейкозы
- Первичная лимфома центральной нервной системы у взрослых
Related standards of medical care
- Стандарт санаторно-курортной помощи больным злокачественными новообразованиями лимфоидной, кроветворной и родственной им тканей
- Стандарт специализированной медицинской помощи после трансплантации аллогенного костного мозга (обследование и коррекция лечения)
- Стандарт специализированной медицинской помощи при донорстве аутологичного костного мозга