Другие названия и синонимы
Remifentanil.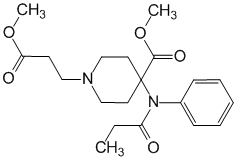
Фармакологическая группа
|
|
Латинское название
Remifentanilum ( Remifentanili).
Химическое название
4-(Метоксикарбонил)-4-[(1-оксопропил)фениламино]-1-пиперидинпропановой кислоты метиловый эфир (в виде гидрохлорида).
Используется в лечении
Код CAS
132875-61-7.
Фармакологическое действие
Анальгезирующее (опиоидное).
Характеристика вещества
Ремифентанила гидрохлорид - лиофилизированный порошок белого или почти белого цвета, pKa составляет 7,07; коэффициент распределения n-октанол/вода равен 17,9 при pH 7,3. Молекулярная масса 412,91.
Фармакодинамика
Селективно стимулирует мю-опиоидные рецепторы. Анальгетический эффект характеризуется быстрым наступлением (начало действия - в пределах 1 мин, максимум - через 1-2 мин после введения) и короткой продолжительностью - 5-10 мин после окончания инфузии. При использовании во время наркоза выход из анестезии был быстрым, предсказуемым и не зависел от продолжительности инфузии.
Дозозависимо угнетает сердечную и дыхательную функции. Вызывает ригидность скелетных мышц, особенно при введении в средних или больших дозах в течение короткого периода времени. При введении доз свыше 1 мкг/кг в течение 30-60 с способствует возникновению ригидности мышц грудной клетки и смыканию голосовой щели.
Концентрация в крови пропорциональна дозе в рекомендуемом диапазоне доз. Увеличение скорости инфузии на каждые 0,1 мкг/кг/мин приводит к повышению концентрации в крови на 2,5 нг/мл. Связывание с белками плазмы крови - около 70% (преимущественно с кислым альфа1-гликопротеином). Начальный объем распределения (кровь и хорошо перфузируемые ткани) - 100 мл/кг, объем распределения в периферических тканях при достижении равновесной концентрации - 350 мл/кг. Быстро гидролизуется под действием неспецифических эстераз крови и тканей с образованием неактивного (активность в 4600 раз ниже, чем у ремифентанила) карбоксильного метаболита. Не биотрансформируется холинэстеразой плазмы крови. У взрослых молодых людей клиренс ремифентанила около 40 мл/мин/кг. При операциях с искусственным кровообращением в условиях гипотермии (28 °C) уменьшение клиренса ремифентанила составляет до 20%. Понижение температуры тела на 1 °C приводит к уменьшению клиренса на 3%. 1/2T1/2 составляет 3-10 мин и не зависит от введенной дозы. Вследствие быстрого распределения и выведения концентрация в крови уменьшается на 50% в течение 3-6 мин как после введения в течение 1 мин, так и по окончании длительной инфузии. 1/2T1/2 метаболита у здоровых взрослых людей - 2 Выводится почками (около 95% в виде карбоксильного метаболита).
Фармакокинетические параметры не изменяются при выраженном нарушении функции печени или выраженной почечной недостаточности (Cl креатинина <10 мл/мин). У пациентов с удаленной или отсутствующей почкой 1/2T1/2 карбоксильного метаболита увеличивается до 30.
У детей в возрасте от 5 дней до 17 лет клиренс ремифентанила и объем распределения при стабильной концентрации выше у детей младшего возраста, а по достижении 17-летнего возраста эти показатели уменьшаются до значений, свойственных молодым здоровым людям. У новорожденных 1/2T1/2 ремифентанила сопоставим с таковым у взрослых.
Фармакокинетические параметры несколько отличаются у пожилых пациентов (старше 65 лет) по сравнению с молодыми (25 лет) здоровыми добровольцами: клиренс ремифентанила ниже (приблизительно на 25%), ЕС50 ремифентанила для появления дельта волн на ЭЭГ на 50% ниже.
Канцерогенность, мутагенность, влияние на фертильность.
Данные об исследовании канцерогенности ремифентанила у животных отсутствуют.
В опытах in vitro >in vitro на прокариотических клетках мутагеного действия не наблюдалось. В тестах на культуре клеток китайского хомячка, а также в тестах in vivo >in vivo у крыс и мышей кластогенного действия не обнаружено.
В тесте in vitro >in vitro с культурой мышиной лимфомы мутагенное действие проявлялось только в условиях метаболической активации.
Показано снижение фертильности у самцов крыс при ежедневном введении доз, в 40 раз превышающих МРДЧ, в течение 70 дней. Не оказывал влияния на фертильность у самок крыс при введении доз, в 80 раз превышающих МРДЧ, в течение 15 дней до спаривания.
Дозозависимо угнетает сердечную и дыхательную функции. Вызывает ригидность скелетных мышц, особенно при введении в средних или больших дозах в течение короткого периода времени. При введении доз свыше 1 мкг/кг в течение 30-60 с способствует возникновению ригидности мышц грудной клетки и смыканию голосовой щели.
Концентрация в крови пропорциональна дозе в рекомендуемом диапазоне доз. Увеличение скорости инфузии на каждые 0,1 мкг/кг/мин приводит к повышению концентрации в крови на 2,5 нг/мл. Связывание с белками плазмы крови - около 70% (преимущественно с кислым альфа1-гликопротеином). Начальный объем распределения (кровь и хорошо перфузируемые ткани) - 100 мл/кг, объем распределения в периферических тканях при достижении равновесной концентрации - 350 мл/кг. Быстро гидролизуется под действием неспецифических эстераз крови и тканей с образованием неактивного (активность в 4600 раз ниже, чем у ремифентанила) карбоксильного метаболита. Не биотрансформируется холинэстеразой плазмы крови. У взрослых молодых людей клиренс ремифентанила около 40 мл/мин/кг. При операциях с искусственным кровообращением в условиях гипотермии (28 °C) уменьшение клиренса ремифентанила составляет до 20%. Понижение температуры тела на 1 °C приводит к уменьшению клиренса на 3%. 1/2T1/2 составляет 3-10 мин и не зависит от введенной дозы. Вследствие быстрого распределения и выведения концентрация в крови уменьшается на 50% в течение 3-6 мин как после введения в течение 1 мин, так и по окончании длительной инфузии. 1/2T1/2 метаболита у здоровых взрослых людей - 2 Выводится почками (около 95% в виде карбоксильного метаболита).
Фармакокинетические параметры не изменяются при выраженном нарушении функции печени или выраженной почечной недостаточности (Cl креатинина <10 мл/мин). У пациентов с удаленной или отсутствующей почкой 1/2T1/2 карбоксильного метаболита увеличивается до 30.
У детей в возрасте от 5 дней до 17 лет клиренс ремифентанила и объем распределения при стабильной концентрации выше у детей младшего возраста, а по достижении 17-летнего возраста эти показатели уменьшаются до значений, свойственных молодым здоровым людям. У новорожденных 1/2T1/2 ремифентанила сопоставим с таковым у взрослых.
Фармакокинетические параметры несколько отличаются у пожилых пациентов (старше 65 лет) по сравнению с молодыми (25 лет) здоровыми добровольцами: клиренс ремифентанила ниже (приблизительно на 25%), ЕС50 ремифентанила для появления дельта волн на ЭЭГ на 50% ниже.
Канцерогенность, мутагенность, влияние на фертильность.
Данные об исследовании канцерогенности ремифентанила у животных отсутствуют.
В опытах in vitro >in vitro на прокариотических клетках мутагеного действия не наблюдалось. В тестах на культуре клеток китайского хомячка, а также в тестах in vivo >in vivo у крыс и мышей кластогенного действия не обнаружено.
В тесте in vitro >in vitro с культурой мышиной лимфомы мутагенное действие проявлялось только в условиях метаболической активации.
Показано снижение фертильности у самцов крыс при ежедневном введении доз, в 40 раз превышающих МРДЧ, в течение 70 дней. Не оказывал влияния на фертильность у самок крыс при введении доз, в 80 раз превышающих МРДЧ, в течение 15 дней до спаривания.
Показания к применению
В качестве анальгетического компонента при вводном наркозе и/или для поддержания общей анестезии при хирургических вмешательствах (в тч в кардиохирургии). пролонгация обезболивания непосредственно после операции (под строгим медицинским контролем) при переходе на анальгезию препаратами длительного действия.
Противопоказания
Гиперчувствительность, в тч к другим аналогам фентанила, эпидуральная и спинальная анестезия (вследствие наличия в составе глицина).
При беременности и кормлении грудью
Возможно, если ожидаемый эффект терапии превышает потенциальный риск для плода и новорожденного. Адекватные хорошо контролируемые исследования безопасности применения у беременных женщин, а также во время родов или при кесаревом сечении не проводились.
У крыс и кроликов, получавших дозы, в 400 и 125 раз соответственно превышающие МРДЧ, тератогенного эффекта не наблюдалось.
Ремифентанил проходит через плаценту. У новорожденных, чьи матери незадолго до родов получали ремифентанил, может наблюдаться угнетение дыхания и другие опиоидные эффекты. Есть данные о том, что концентрация ремифентанила в крови плода составляет 50-100% уровня в организме матери.
Категория действия на плод по FDA. с.
Неизвестно, проникает ли вещество в грудное молоко женщин. Производные ремифентанила определялись в молоке крыс.
У крыс и кроликов, получавших дозы, в 400 и 125 раз соответственно превышающие МРДЧ, тератогенного эффекта не наблюдалось.
Ремифентанил проходит через плаценту. У новорожденных, чьи матери незадолго до родов получали ремифентанил, может наблюдаться угнетение дыхания и другие опиоидные эффекты. Есть данные о том, что концентрация ремифентанила в крови плода составляет 50-100% уровня в организме матери.
Категория действия на плод по FDA. с.
Неизвестно, проникает ли вещество в грудное молоко женщин. Производные ремифентанила определялись в молоке крыс.
Побочные эффекты
Очень часто (≥ 10%): тошнота, рвота, артериальная гипотензия, ригидность скелетных мышц.
Часто (≥ 1% worse 10%): послеоперационный озноб и гипертензия, брадикардия, острое угнетение дыхания, апноэ.
Нечасто (≥ 0,1 worse 1%): гипоксия, запор, послеоперационная боль.
Редко ( worse 0,1%): седативный эффект (в период выхода из наркоза).
Очень редко: аллергические реакции, включая анафилаксию.
Часто (≥ 1% worse 10%): послеоперационный озноб и гипертензия, брадикардия, острое угнетение дыхания, апноэ.
Нечасто (≥ 0,1 worse 1%): гипоксия, запор, послеоперационная боль.
Редко ( worse 0,1%): седативный эффект (в период выхода из наркоза).
Очень редко: аллергические реакции, включая анафилаксию.
Взаимодействие
Несовместим (не следует смешивать) в одной инфузионной емкости с растворами Рингера-лактата, Рингера-лактата с добавлением 5% декстрозы, пропофола, но совместим с этими растворами при введении через одну магистраль.
При совместном применении со средствами, угнетающими ЦНС, возможно увеличение частоты побочных эффектов этих средств (необходимо уменьшение дозы последних). Средства, снижающие сократимость миокарда (бета-адреноблокаторы, блокаторы кальциевых каналов ) усиливают влияние на сердечно-сосудистую систему (артериальная гипотензия, брадикардия).
При совместном применении со средствами, угнетающими ЦНС, возможно увеличение частоты побочных эффектов этих средств (необходимо уменьшение дозы последних). Средства, снижающие сократимость миокарда (бета-адреноблокаторы, блокаторы кальциевых каналов ) усиливают влияние на сердечно-сосудистую систему (артериальная гипотензия, брадикардия).
Передозировка
Симптомы. Усиление побочных эффектов (могут проявиться только сразу после введения) - апноэ. смыкание голосовой щели. брадикардия. гипотензия. гипоксемия. ригидность скелетных мышц.
Лечение: прекращение введения, поддержание проходимости дыхательных путей, вспомогательная или ИВЛ, поддержание функции сердечно-сосудистой системы, в случае гипотензии - сосудосуживающие средства. Если угнетение дыхания сочетается с ригидностью мышц - введение средств, блокирующих нервно-мышечную передачу (для облегчения вентиляции легких).
Специфический антидот - опиоидный антагонист (налоксон); вводят в/в.
Лечение: прекращение введения, поддержание проходимости дыхательных путей, вспомогательная или ИВЛ, поддержание функции сердечно-сосудистой системы, в случае гипотензии - сосудосуживающие средства. Если угнетение дыхания сочетается с ригидностью мышц - введение средств, блокирующих нервно-мышечную передачу (для облегчения вентиляции легких).
Специфический антидот - опиоидный антагонист (налоксон); вводят в/в.
|
|
Способ применения и дозы
В/в инфузионно, взрослым. Вводный наркоз: инфузия со скоростью 0,5-1 мкг/кг/мин после предшествующей болюсной инъекции в дозе 1 мкг/кг в течение не менее 30 с или без нее (если интубацию трахеи проводят позже чем через 8-10 мин от начала инфузии ремифентанила).
Поддержание общей анестезии с ИВЛ. После интубации трахеи скорость инфузии уменьшают в соответствии с применяемой методикой; скорость введения можно титровать, повышая ее на 25-100% или понижая на 25-50% каждые 2-5 мин для достижения необходимого уровня анестезии. При поверхностной анестезии возможно дополнительное болюсное введение в дозе 0,5-1 мкг/кг каждые 2-5 мин.
Общая анестезия с самостоятельным дыханием. Начальная скорость инфузии 0,04 мкг/кг/мин c последующим титрованием в диапазоне доз 0,025-0,1 мкг/кг/мин (болюсное введение не рекомендуется).
Поддержание анальгезии в раннем послеоперационном периоде. У пациентов, находящихся на ИВЛ, с индивидуальной скоростью до развития эффекта; при самостоятельном дыхании сначала уменьшают скорость инфузии до 0,1 мкг/кг/мин, затем титруют ее в интервале доз 0,025-0,2 мкг/кг/мин, изменяя не более чем на 0,025 мкг/кг/мин каждые 5 мин (болюсное введение не рекомендуется).
В сердечно-сосудистой хирургии: при вводном наркозе - инфузия со скоростью 1 мкг/кг/мин (интубацию трахеи следует проводить не ранее чем через 5 мин после начала инфузии), болюсное введение не рекомендуется.
Поддержание общей анестезии. Скорость подбирают индивидуально, в зависимости от развития эффекта, при необходимости - в виде болюса. Для пациентов с высоким риском развития осложнений максимальная болюсная доза 0,5 мкг/кг.
Поддержание анальгезии в раннем послеоперационном периоде (после экстубации). До перевода в послеоперационную палату сохраняется скорость инфузии, соответствующая окончанию операции, затем со скоростью 1 мкг/кг/мин до момента отключения от ИВЛ. Прекращать инфузию рекомендуется в 3-4 этапа с интервалами 10 мин путем уменьшения скорости введения на 50% на каждом этапе.
У пациентов пожилого возраста начальная доза в два раза меньше обычной рекомендуемой, коррекция доз необходима на всех этапах анестезии.
Детям в возрасте 1-12 лет: для поддержания анестезии - в виде болюса в течение не менее 30 с со скоростью 1 мкг/кг; затем непрерывная инфузия (в тч в течение 5 мин до начала операции, если не использовалось болюсное введение) с начальной скоростью 0,25-0,4 мкг/кг/мин (обычная скорость для поддержания анестезии 0,05-1,3 мкг/кг/мин, в зависимости от одновременно применяемого анестетика).
Поддержание общей анестезии с ИВЛ. После интубации трахеи скорость инфузии уменьшают в соответствии с применяемой методикой; скорость введения можно титровать, повышая ее на 25-100% или понижая на 25-50% каждые 2-5 мин для достижения необходимого уровня анестезии. При поверхностной анестезии возможно дополнительное болюсное введение в дозе 0,5-1 мкг/кг каждые 2-5 мин.
Общая анестезия с самостоятельным дыханием. Начальная скорость инфузии 0,04 мкг/кг/мин c последующим титрованием в диапазоне доз 0,025-0,1 мкг/кг/мин (болюсное введение не рекомендуется).
Поддержание анальгезии в раннем послеоперационном периоде. У пациентов, находящихся на ИВЛ, с индивидуальной скоростью до развития эффекта; при самостоятельном дыхании сначала уменьшают скорость инфузии до 0,1 мкг/кг/мин, затем титруют ее в интервале доз 0,025-0,2 мкг/кг/мин, изменяя не более чем на 0,025 мкг/кг/мин каждые 5 мин (болюсное введение не рекомендуется).
В сердечно-сосудистой хирургии: при вводном наркозе - инфузия со скоростью 1 мкг/кг/мин (интубацию трахеи следует проводить не ранее чем через 5 мин после начала инфузии), болюсное введение не рекомендуется.
Поддержание общей анестезии. Скорость подбирают индивидуально, в зависимости от развития эффекта, при необходимости - в виде болюса. Для пациентов с высоким риском развития осложнений максимальная болюсная доза 0,5 мкг/кг.
Поддержание анальгезии в раннем послеоперационном периоде (после экстубации). До перевода в послеоперационную палату сохраняется скорость инфузии, соответствующая окончанию операции, затем со скоростью 1 мкг/кг/мин до момента отключения от ИВЛ. Прекращать инфузию рекомендуется в 3-4 этапа с интервалами 10 мин путем уменьшения скорости введения на 50% на каждом этапе.
У пациентов пожилого возраста начальная доза в два раза меньше обычной рекомендуемой, коррекция доз необходима на всех этапах анестезии.
Детям в возрасте 1-12 лет: для поддержания анестезии - в виде болюса в течение не менее 30 с со скоростью 1 мкг/кг; затем непрерывная инфузия (в тч в течение 5 мин до начала операции, если не использовалось болюсное введение) с начальной скоростью 0,25-0,4 мкг/кг/мин (обычная скорость для поддержания анестезии 0,05-1,3 мкг/кг/мин, в зависимости от одновременно применяемого анестетика).
Меры предосторожности применения
Не рекомендуется для использования у детей до 1 года, для вводной анестезии и в кардиохирургии у детей до 12 лет (имеющиеся клинические данные недостаточны для выработки рекомендаций).
Вызывает лекарственную зависимость. В случае ранней выписки из стационара не следует управлять транспортными средствами и выполнять работу, связанную с повышенной концентрацией внимания.
Не следует смешивать с другими ЛС. Не рекомендуется вводить через одну магистраль с кровью/сывороткой/плазмой, содержащиеся в них неспецифические эстеразы могут вызывать гидролиз препарата.
Вызывает лекарственную зависимость. В случае ранней выписки из стационара не следует управлять транспортными средствами и выполнять работу, связанную с повышенной концентрацией внимания.
Не следует смешивать с другими ЛС. Не рекомендуется вводить через одну магистраль с кровью/сывороткой/плазмой, содержащиеся в них неспецифические эстеразы могут вызывать гидролиз препарата.
Особые указания
Применение возможно только в отделениях, полностью оснащенных оборудованием для мониторирования и поддержания функций дыхательной и сердечно-сосудистой систем. Непрерывная инфузия проводится только с помощью специально откалиброванного инфузионного устройства (перфузор, инфузомат) и в/в канюли. Предназначен только для в/в введения.
Пациенты с выраженным нарушением функции печени могут оказаться более чувствительными к угнетающему действию ремифентанила на функцию дыхания. Ослабленные, пожилые или пациенты с гиповолемией более чувствительны к действию ремифентанила на сердечно-сосудистую систему.
Пациенты с выраженным нарушением функции печени могут оказаться более чувствительными к угнетающему действию ремифентанила на функцию дыхания. Ослабленные, пожилые или пациенты с гиповолемией более чувствительны к действию ремифентанила на сердечно-сосудистую систему.
Входит в состав
- — Ултива