Другие названия и синонимы
Docetaxel.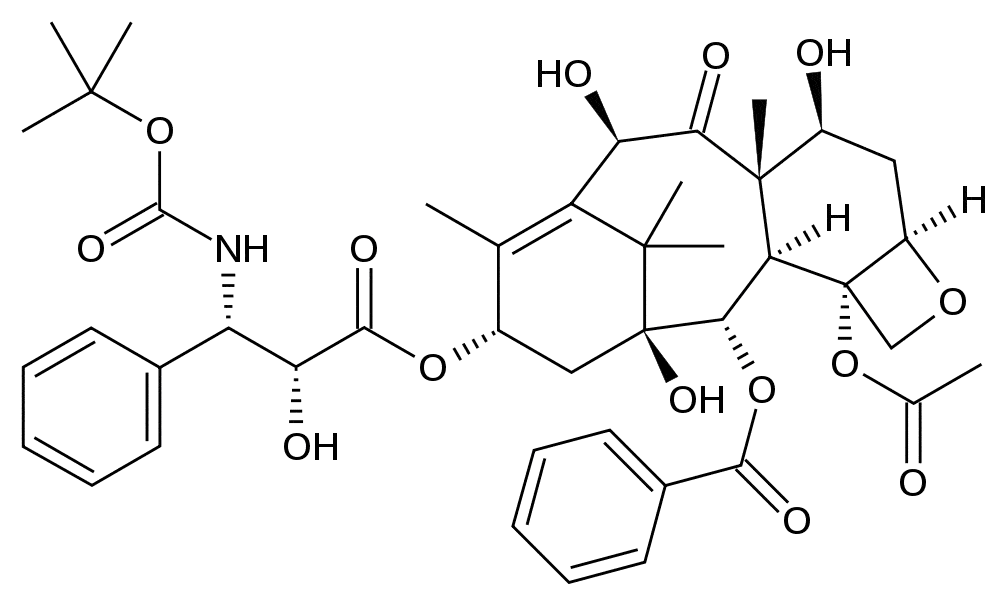
Фармакологическая группа
|
|
Латинское название
Docetaxelum ( Docetaxeli).
Химическое название
(2R,3S)-N-Карбокси-3-фенилизосерин-N-трет-бутил-13-5бета,20-эпокси-1,2альфа,4,7бета,10бета,13альфа-гексагидрокситакс-11-ен-9-он-4- ацетат-2-бензоата тригидрат.
Используется в лечении
- C76.0 Злокачественное новообразование головы, лица и шеи
- C61 Злокачественное новообразование предстательной железы
- C56 Злокачественное новообразование яичника
- C50 Злокачественные новообразования молочной железы
- C34 Злокачественное новообразование бронхов и легкого
- C16 Злокачественное новообразование желудка
- C77 Вторичное и неуточненное злокачественное новообразование лимфатических узлов
Код CAS
148408-66-6.
Фармакологическое действие
Противоопухолевое, цитостатическое.
Характеристика вещества
Полусинтетическое противоопухолевое средство растительного происхождения, получаемое путем химического синтеза из природного сырья - игл тиса европейского (Taxus baccata). Белый или почти белый порошок, высоко липофильный и практически нерастворимый в воде. Молекулярная масса 861,9.
Фармакодинамика
Повреждает микротубулярную сеть в клетках на стадии митоза и в интерфазе. Связывается со свободным тубулином, стимулирует сбор тубулина в стабильные микротрубочки и препятствует их распаду. В результате образуются связки микротрубочек, которые стабилизируются, теряют способность к нормальному функционированию, что приводит к нарушению фазы митоза и межфазных взаимодействий в клетках.
Фармакокинетика
Фармакокинетический профиль доцетаксела описывается трехфазной моделью с 1/2T1/2 4 мин, 36 мин и 11,4 ч соответственно для фаз альфа, бета и гамма. Начальное быстрое снижение концентрации в крови отражает распределение доцетаксела из крови в ткани, а терминальная фаза обусловлена сравнительно медленным высвобождением из периферических тканей. Средние величины системного клиренса и объема распределения в равновесном состоянии - 21 л/ч/м2 и 113 л соответственно. В исследованиях in vitro >in vitro показано, что связывание доцетаксела с белками составляет 94% (преимущественно с альфа1-кислым гликопротеином, альбумином, липопротеинами). У трех больных раком связывание с белками плазмы in vitro >in vitro было около 97%. Дексаметазон не влияет на связывание доцетаксела с белками. Биотрансформация происходит в печени при участии изоферментов цитохрома P450.
Исследования с 14С-доцетакселом, проведенные у 3 больных раком, показали, что в течение 7 дней доцетаксел выводится с мочой и фекалиями после окисления трет-бутиловой эфирной группы с участием цитохром P450; экскреция с мочой и фекалиями составляли соответственно 6 и 75% радиоактивной дозы. Примерно 80% радиоактивного препарата, выводимого с фекалиями, обнаруживается в течение 48 ч в виде основного неактивного метаболита и трех менее значимых неактивных метаболитов и, в очень незначительном количестве, в неизмененном виде.
Популяционный фармакокинетический анализ показал, что фармакокинетика доцетаксела не зависела от возраста и пола пациента. У небольшого числа больных (n=23) с признаками легко выраженного нарушения функции печени (уровни АЛТ и АСТ ≥1,5 норм в сочетании с повышением активности ЩФ ≥2,5 нормы) общий клиренс был снижен на 27% по сравнению со средним показателем. Клиренс доцетаксела не менялся у больных с легкой или умеренной задержкой жидкости; сведений о клиренсе препарата у больных с выраженной задержкой жидкости нет. При использовании доцетаксела в комбинации с доксорубицином клиренс доцетаксела увеличивался при сохранении его эффективности. При этом клиренс доксорубицина и уровень доксорубицинола (метаболита доксорубицина) в плазме не менялся.
Канцерогенность, мутагенность, влияние на фертильность.
Исследования потенциальной канцерогенности доцетаксела не проведены.
Доцетаксел проявлял кластогенное действие в тесте выявления хромосомных аберраций на K1 клетках яичника китайского хомячка in vitro >in vitro и в микроядерном тесте на мышах in vivo >in vivo. Не проявлял мутагенной активности в тесте Эймса, при анализе генных мутаций на клетках сHO/HGPRT (тест с гипоксантин-гуанинфосфорибозилтрансферазой клеток яичника китайского хомячка).
В экспериментальных исследованиях при в/в введении крысам доцетаксела в дозах до 0,3 мг/кг (около 1/50 рекомендуемой дозы для человека (РДЧ) при расчете на мг/м2) не обнаружено нарушения фертильности, но сообщалось о снижении массы яичек. Это коррелирует с данными исследований токсичности доцетаксела на протяжении 10 циклов (однократное введение каждый 21-й день в течение 6 мес) у крыс и собак, где тестикулярная атрофия или дегенерация наблюдались при в/в введении крысам доз 5 мг/кг и собакам доз 0,375 мг/кг (около 1/3 и 1/15 РДЧ при расчете на мг/м2 соответственно). Увеличение частоты введения доцетаксела крысам вызывает сходные эффекты при меньших дозах.
Исследования с 14С-доцетакселом, проведенные у 3 больных раком, показали, что в течение 7 дней доцетаксел выводится с мочой и фекалиями после окисления трет-бутиловой эфирной группы с участием цитохром P450; экскреция с мочой и фекалиями составляли соответственно 6 и 75% радиоактивной дозы. Примерно 80% радиоактивного препарата, выводимого с фекалиями, обнаруживается в течение 48 ч в виде основного неактивного метаболита и трех менее значимых неактивных метаболитов и, в очень незначительном количестве, в неизмененном виде.
Популяционный фармакокинетический анализ показал, что фармакокинетика доцетаксела не зависела от возраста и пола пациента. У небольшого числа больных (n=23) с признаками легко выраженного нарушения функции печени (уровни АЛТ и АСТ ≥1,5 норм в сочетании с повышением активности ЩФ ≥2,5 нормы) общий клиренс был снижен на 27% по сравнению со средним показателем. Клиренс доцетаксела не менялся у больных с легкой или умеренной задержкой жидкости; сведений о клиренсе препарата у больных с выраженной задержкой жидкости нет. При использовании доцетаксела в комбинации с доксорубицином клиренс доцетаксела увеличивался при сохранении его эффективности. При этом клиренс доксорубицина и уровень доксорубицинола (метаболита доксорубицина) в плазме не менялся.
Канцерогенность, мутагенность, влияние на фертильность.
Исследования потенциальной канцерогенности доцетаксела не проведены.
Доцетаксел проявлял кластогенное действие в тесте выявления хромосомных аберраций на K1 клетках яичника китайского хомячка in vitro >in vitro и в микроядерном тесте на мышах in vivo >in vivo. Не проявлял мутагенной активности в тесте Эймса, при анализе генных мутаций на клетках сHO/HGPRT (тест с гипоксантин-гуанинфосфорибозилтрансферазой клеток яичника китайского хомячка).
В экспериментальных исследованиях при в/в введении крысам доцетаксела в дозах до 0,3 мг/кг (около 1/50 рекомендуемой дозы для человека (РДЧ) при расчете на мг/м2) не обнаружено нарушения фертильности, но сообщалось о снижении массы яичек. Это коррелирует с данными исследований токсичности доцетаксела на протяжении 10 циклов (однократное введение каждый 21-й день в течение 6 мес) у крыс и собак, где тестикулярная атрофия или дегенерация наблюдались при в/в введении крысам доз 5 мг/кг и собакам доз 0,375 мг/кг (около 1/3 и 1/15 РДЧ при расчете на мг/м2 соответственно). Увеличение частоты введения доцетаксела крысам вызывает сходные эффекты при меньших дозах.
Показания к применению
Адъювантная терапия при операбельном раке молочной железы с поражением регионарных лимфоузлов в комбинации с доксорубицином и циклофосфамидом.
Местно-распространенный или метастатический рак молочной железы - в комбинации с доксорубицином в качестве первичного химиотерапевтического лечения (1-я линия) или в качестве терапии 2-й линии: в монотерапии. при неэффективности предшествующего лечения. включавшего в себя антрациклины или алкилирующие средства. и в комбинации с капецитабином. если предшествующее лечение включало в себя антрациклины.
Метастатический рак молочной железы с опухолевой экспрессией HER2 в комбинации с трастузумабом, в случае отсутствия предшествующей химиотерапии.
Неоперабельный местно-распространенный или метастатический немелкоклеточный рак легкого (в комбинации с цисплатином или карбоплатином) в качестве терапии 1-й линии или в монотерапии в качестве терапии 2-й линии при неэффективности химиотерапии. основанной на препаратах платины.
Метастатический рак яичников при неэффективности предшествующей терапии 1-й линии (2-я линия терапии).
Неоперабельный местно-распространенный плоскоклеточный рак головы и шеи (в комбинации с цисплатином и 5-фторурацилом) в качестве терапии 1-й линии.
Метастатический плоскоклеточный рак головы и шеи при неэффективности предшествующего лечения (терапия 2-й линии).
Метастатический гормонорезистентный рак предстательной железы (в комбинации с преднизоном или преднизолоном).
Метастатический рак желудка, включая кардиальный отдел (в комбинации с цисплатином и 5-фторурацилом), в качестве терапии 1-й линии.
Местно-распространенный или метастатический рак молочной железы - в комбинации с доксорубицином в качестве первичного химиотерапевтического лечения (1-я линия) или в качестве терапии 2-й линии: в монотерапии. при неэффективности предшествующего лечения. включавшего в себя антрациклины или алкилирующие средства. и в комбинации с капецитабином. если предшествующее лечение включало в себя антрациклины.
Метастатический рак молочной железы с опухолевой экспрессией HER2 в комбинации с трастузумабом, в случае отсутствия предшествующей химиотерапии.
Неоперабельный местно-распространенный или метастатический немелкоклеточный рак легкого (в комбинации с цисплатином или карбоплатином) в качестве терапии 1-й линии или в монотерапии в качестве терапии 2-й линии при неэффективности химиотерапии. основанной на препаратах платины.
Метастатический рак яичников при неэффективности предшествующей терапии 1-й линии (2-я линия терапии).
Неоперабельный местно-распространенный плоскоклеточный рак головы и шеи (в комбинации с цисплатином и 5-фторурацилом) в качестве терапии 1-й линии.
Метастатический плоскоклеточный рак головы и шеи при неэффективности предшествующего лечения (терапия 2-й линии).
Метастатический гормонорезистентный рак предстательной железы (в комбинации с преднизоном или преднизолоном).
Метастатический рак желудка, включая кардиальный отдел (в комбинации с цисплатином и 5-фторурацилом), в качестве терапии 1-й линии.
Противопоказания
Гиперчувствительность, нейтропения (<1,5·109/л), выраженное нарушение функции печени (повышение уровня билирубина, трансаминаз, ЩФ - см «Меры предосторожности»).
Ограничения к использованию
Детский возраст (безопасность и эффективность применения изучена недостаточно, имеется ограниченный опыт применения у детей).
При беременности и кормлении грудью
Противопоказано при беременности.
Категория действия на плод по FDA. D.
На время лечения следует прекратить грудное вскармливание (неизвестно, проникает ли доцетаксел в грудное молоко).
Категория действия на плод по FDA. D.
На время лечения следует прекратить грудное вскармливание (неизвестно, проникает ли доцетаксел в грудное молоко).
|
|
Побочные эффекты
Со стороны сердечно-сосудистой системы и крови (кроветворение. гемостаз): нейтропения. тромбоцитопения. анемия. нарушение сердечного ритма. сердечная недостаточность. понижение или повышение АД. случаи венозной тромбоэмболии и инфаркта миокарда.
Со стороны органов ЖКТ. Тошнота. рвота. диарея/запор. анорексия. стоматит. нарушение вкуса. эзофагит. боль в области желудка. повышение сывороточных уровней АСТ. АЛТ. ЩФ. гипербилирубинемия. случаи желудочно-кишечного кровотечения.
Со стороны кожных покровов. Алопеция. кожная сыпь. часто сопровождающаяся зудом. иногда с последующей десквамацией. приводящие в ряде случаев к прерыванию или прекращению терапии доцетакселом. гипо- или гиперпигментация ногтей и онихолизис.
Аллергические реакции. Реакции гиперчувствительности легкой или умеренной степени выраженности (приливы крови к лицу. сыпь в сочетании с зудом. стеснение в груди. боль в спине. одышка и лекарственная лихорадка или озноб). тяжелые реакции (сопровождающиеся артериальной гипотензией и/или бронхоспазмом или генерализованной сыпью/эритемой) - см «Меры предосторожности».
Прочие. Периферическая нейропатия (парестезия. дизестезия или боль. слабость). периферические отеки (первоначально обычно появляются на нижних конечностях). асцит. астения. артралгия и миалгия. реакции в месте введения (гиперпигментация. воспаление. покраснение или сухость кожи. флебит. кровоизлияние или отек вены).
Со стороны органов ЖКТ. Тошнота. рвота. диарея/запор. анорексия. стоматит. нарушение вкуса. эзофагит. боль в области желудка. повышение сывороточных уровней АСТ. АЛТ. ЩФ. гипербилирубинемия. случаи желудочно-кишечного кровотечения.
Со стороны кожных покровов. Алопеция. кожная сыпь. часто сопровождающаяся зудом. иногда с последующей десквамацией. приводящие в ряде случаев к прерыванию или прекращению терапии доцетакселом. гипо- или гиперпигментация ногтей и онихолизис.
Аллергические реакции. Реакции гиперчувствительности легкой или умеренной степени выраженности (приливы крови к лицу. сыпь в сочетании с зудом. стеснение в груди. боль в спине. одышка и лекарственная лихорадка или озноб). тяжелые реакции (сопровождающиеся артериальной гипотензией и/или бронхоспазмом или генерализованной сыпью/эритемой) - см «Меры предосторожности».
Прочие. Периферическая нейропатия (парестезия. дизестезия или боль. слабость). периферические отеки (первоначально обычно появляются на нижних конечностях). асцит. астения. артралгия и миалгия. реакции в месте введения (гиперпигментация. воспаление. покраснение или сухость кожи. флебит. кровоизлияние или отек вены).
Взаимодействие
В исследованиях in vitro >in vitro показано, что метаболизм доцетаксела может меняться при одновременном применении веществ, которые индуцируют, ингибируют или метаболизируются с участием изофермента сYP3A: циклоспорин, терфенадин, кетоконазол, эритромицин и другие (необходимо соблюдать осторожность при одновременном назначении, учитывая возможность выраженного взаимодействия).
Доцетаксел в значительной степени связывается с белками ( см Фармакокинетика). Хотя возможное взаимодействие доцетаксела с другими препаратами in vivo >in vivo не изучалось, однако in vitro >in vitro другие лекарственные вещества, тесно связывающиеся с белками, такие как эритромицин, дифенгидрамин, пропранолол, пропафенон, фенитоин, салицилаты, сульфаметоксазол и вальпроат натрия не влияли на связывание доцетаксела с белками. Доцетаксел не влиял на связывание дигитоксина.
При использовании доцетаксела в комбинации с доксорубицином клиренс доцетаксела увеличивался при сохранении его эффективности. При этом клиренс доксорубицина и уровень доксорубицинола (метаболита доксорубицина) в плазме не изменялся.
Клиренс карбоплатина при комбинированной терапии с доцетакселом увеличивается на 50% по сравнению с таковым при монотерапии карбоплатином.
Не выявлено влияния доцетаксела на фармакокинетику (Cmax и AUC) главного метаболита капецитабина (5DFUR) и влияния капецитабина на фармакокинетику (Cmax и AUC) доцетаксела.
Доцетаксел в значительной степени связывается с белками ( см Фармакокинетика). Хотя возможное взаимодействие доцетаксела с другими препаратами in vivo >in vivo не изучалось, однако in vitro >in vitro другие лекарственные вещества, тесно связывающиеся с белками, такие как эритромицин, дифенгидрамин, пропранолол, пропафенон, фенитоин, салицилаты, сульфаметоксазол и вальпроат натрия не влияли на связывание доцетаксела с белками. Доцетаксел не влиял на связывание дигитоксина.
При использовании доцетаксела в комбинации с доксорубицином клиренс доцетаксела увеличивался при сохранении его эффективности. При этом клиренс доксорубицина и уровень доксорубицинола (метаболита доксорубицина) в плазме не изменялся.
Клиренс карбоплатина при комбинированной терапии с доцетакселом увеличивается на 50% по сравнению с таковым при монотерапии карбоплатином.
Не выявлено влияния доцетаксела на фармакокинетику (Cmax и AUC) главного метаболита капецитабина (5DFUR) и влияния капецитабина на фармакокинетику (Cmax и AUC) доцетаксела.
Передозировка
Симптомы. Миелосупрессия, периферическая нейротоксичность, воспаление слизистых оболочек.
Лечение. Необходима госпитализация больного в специализированное отделение, тщательный мониторинг жизненно важных функций, симптоматическая терапия. Больным следует как можно скорее назначить гранулоцитарный колониестимулирующий фактор. Специфический антидот неизвестен.
Лечение. Необходима госпитализация больного в специализированное отделение, тщательный мониторинг жизненно важных функций, симптоматическая терапия. Больным следует как можно скорее назначить гранулоцитарный колониестимулирующий фактор. Специфический антидот неизвестен.
Способ применения и дозы
В/в медленно (в течение 1 ч), однократно, каждые 3 нед, в дозе 75-100 мг/м2 (в зависимости от показаний и схемы химиотерапии).
Меры предосторожности применения
Лечение проводится только при участии опытного специалиста по противоопухолевой терапии при наличии условий, необходимых для купирования осложнений (в специализированном стационаре).
Для предупреждения реакций повышенной чувствительности, а также с целью уменьшения задержки жидкости всем больным до введения доцетаксела проводится премедикация глюкокортикоидами, например дексаметазоном в дозе 16 мг/сут (по 8 мг 2 раза в день) внутрь, в течение 3 дней, начиная за 1 день до введения доцетаксела.
У больных раком предстательной железы, получающих сопутствующее лечение преднизоном или преднизолоном, проводится премедикация дексаметазоном в дозе 8 мг за 12, 3 и 1 ч до начала введения доцетаксела.
Для снижения риска развития гематологических осложнений рекомендуется профилактическое введение колониестимулирующего фактора.
Необходимо тщательное наблюдение за больными, особенно во время первой и второй инфузий доцетаксела, ввиду возможности развития реакций гиперчувствительности. Легкие проявления гиперчувствительности (покраснение лица или локализованные кожные реакции) не требуют прерывания введения препарата. При развитии тяжелых реакций гиперчувствительности (артериальная гипотензия и/или бронхоспазм, генерализованная сыпь/эритема) необходимо прекращение инфузии и проведение соответствующих лечебных мероприятий по купированию осложнений. Повторное использование доцетаксела у таких пациентов не разрешается.
У всех больных при терапии доцетакселом необходим тщательный регулярный мониторинг показателей периферической крови. При развитии серьезных побочных реакций (нейтропения <0,5·109/л, сохраняющаяся более 7 дней, или фебрильная нейтропения, или развитие выраженных кожных реакций, или выраженная периферическая нейропатия) во время терапии доцетакселом дозу препарата для следующих введений следует снизить со 100 до 75 мг/м2 и/или с 75 до 60 мг/м2. Если подобные осложнения возникают и при применении доцетаксела в дозе 60 мг/м2, лечение следует прекратить.
До начала проведения терапии и перед каждым последующим циклом терапии доцетакселом должны определяться функциональные пробы печени.
У больных, получающих монотерапию доцетакселом в дозе 100 мг/м2 и имеющих высокую активность сывороточных трансаминаз (АЛТ и/или АСТ), более чем в 1,5 раза превышающую верхнюю границу нормы (ВГН), в сочетании с повышением сывороточного уровня ЩФ более чем в 2,5 раза выше ВГН, повышен риск развития побочных эффектов: желудочно-кишечное кровотечение, нейтропения IV степени, фебрильная нейтропения, инфекции, выраженная тромбоцитопения, тяжелый стоматит, выраженная кожная токсичность, сепсис. В связи с этим у таких больных с повышенными показателями функции печени рекомендуемая доза доцетаксела составляет 75 мг/м2. У больных с повышенным уровнем билирубина и/или повышенной активностью АЛТ и АСТ (>3,5 ВГН) в сочетании с повышением уровня ЩФ, более чем в 6 раз превышающее ВГН, доцетаксел применять не рекомендуется. В настоящий момент отсутствуют данные относительно использования доцетаксела в комбинации с другими препаратами у больных с нарушением функции печени.
В связи с возможностью задержки жидкости необходимо тщательное наблюдение за больными с выпотом в плевральную полость, перикард или асцитом.
Во время лечения и в течение, по крайней мере, 3 мес после прекращения терапии мужчинам и женщинам детородного возраста необходимо избегать зачатия, применяя надежные методы контрацепции.
Для предупреждения реакций повышенной чувствительности, а также с целью уменьшения задержки жидкости всем больным до введения доцетаксела проводится премедикация глюкокортикоидами, например дексаметазоном в дозе 16 мг/сут (по 8 мг 2 раза в день) внутрь, в течение 3 дней, начиная за 1 день до введения доцетаксела.
У больных раком предстательной железы, получающих сопутствующее лечение преднизоном или преднизолоном, проводится премедикация дексаметазоном в дозе 8 мг за 12, 3 и 1 ч до начала введения доцетаксела.
Для снижения риска развития гематологических осложнений рекомендуется профилактическое введение колониестимулирующего фактора.
Необходимо тщательное наблюдение за больными, особенно во время первой и второй инфузий доцетаксела, ввиду возможности развития реакций гиперчувствительности. Легкие проявления гиперчувствительности (покраснение лица или локализованные кожные реакции) не требуют прерывания введения препарата. При развитии тяжелых реакций гиперчувствительности (артериальная гипотензия и/или бронхоспазм, генерализованная сыпь/эритема) необходимо прекращение инфузии и проведение соответствующих лечебных мероприятий по купированию осложнений. Повторное использование доцетаксела у таких пациентов не разрешается.
У всех больных при терапии доцетакселом необходим тщательный регулярный мониторинг показателей периферической крови. При развитии серьезных побочных реакций (нейтропения <0,5·109/л, сохраняющаяся более 7 дней, или фебрильная нейтропения, или развитие выраженных кожных реакций, или выраженная периферическая нейропатия) во время терапии доцетакселом дозу препарата для следующих введений следует снизить со 100 до 75 мг/м2 и/или с 75 до 60 мг/м2. Если подобные осложнения возникают и при применении доцетаксела в дозе 60 мг/м2, лечение следует прекратить.
До начала проведения терапии и перед каждым последующим циклом терапии доцетакселом должны определяться функциональные пробы печени.
У больных, получающих монотерапию доцетакселом в дозе 100 мг/м2 и имеющих высокую активность сывороточных трансаминаз (АЛТ и/или АСТ), более чем в 1,5 раза превышающую верхнюю границу нормы (ВГН), в сочетании с повышением сывороточного уровня ЩФ более чем в 2,5 раза выше ВГН, повышен риск развития побочных эффектов: желудочно-кишечное кровотечение, нейтропения IV степени, фебрильная нейтропения, инфекции, выраженная тромбоцитопения, тяжелый стоматит, выраженная кожная токсичность, сепсис. В связи с этим у таких больных с повышенными показателями функции печени рекомендуемая доза доцетаксела составляет 75 мг/м2. У больных с повышенным уровнем билирубина и/или повышенной активностью АЛТ и АСТ (>3,5 ВГН) в сочетании с повышением уровня ЩФ, более чем в 6 раз превышающее ВГН, доцетаксел применять не рекомендуется. В настоящий момент отсутствуют данные относительно использования доцетаксела в комбинации с другими препаратами у больных с нарушением функции печени.
В связи с возможностью задержки жидкости необходимо тщательное наблюдение за больными с выпотом в плевральную полость, перикард или асцитом.
Во время лечения и в течение, по крайней мере, 3 мес после прекращения терапии мужчинам и женщинам детородного возраста необходимо избегать зачатия, применяя надежные методы контрацепции.
Особые указания
Следует соблюдать осторожность при применении и приготовлении растворов доцетаксела (как и при работе с другими противоопухолевыми препаратами). При приготовлении растворов рекомендуется пользоваться перчатками. В случае контакта препарата с кожей или слизистыми оболочками необходимо тщательно промывать слизистые оболочки водой, а кожу - водой с мылом.
|
|
Входит в состав
- 2200-2749₽ Доцетаксел (11 фирм)
- 1866-12947₽ Доцетаксел Сандоз (2 фирмы)
- 4093-16700₽ Таксотер (3 фирмы)
- 3205-20100₽ Доцетаксел-Рус (4 фирмы)
- 7680-28311₽ Доцетера (3 фирмы)
- 8700-28400₽ Новотакс (ПК-137 ООО )
- 22230₽ Таутакс (2 фирмы)
- AC=>D
- DC
- DC + трастузумаб
- DCF
- DCН
- DCН + пертузумаб
- DCН5 + пертузумаб
- FLOT
- GemTax
- АС->D + трастузумаб + пертузумаб
- — Доцетаксел безводный
- — Доцетаксел-Келун-Казфарм (Kelun-Kazpharm )
- — Доцетаксел-Фарм-Синтез (Фарм-Синтез ООО )
- — Доцетаксел-Филаксис (2 фирмы)
- — Доцетаксел-промомед
- — Доцетаксела тригидрат-Лонг Шенг Фарма Лимитед (Qilu Pharmaceutical Co. Ltd )
- — Онкодоцел
- — Такселен