Другие названия и синонимы
Mitochondrial diseases.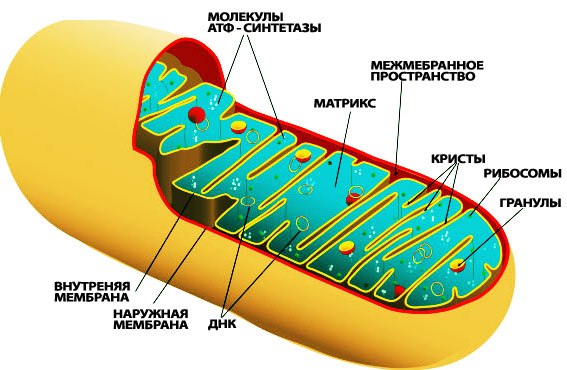
МКБ-10 коды
|
|
Описание
Митохондриальные заболевания - группа наследственных заболеваний, связанных с дефектами в функционировании митохондрий, приводящими к нарушениям энергетических функций в клетках эукариот, в частности, человека.
Митохондриальные заболевания обусловлены генетическими, структурными, биохимическими дефектами митохондрий, приводящими к нарушениям тканевого дыхания. Они передаются только по женской линии к детям обоих полов, так как сперматозоиды передают зиготе половину ядерного генома, а яйцеклетка поставляет и вторую половину генома, и митохондрии. Патологические нарушения клеточного энергетического обмена могут проявляться в виде дефектов различных звеньев в цикле Кребса, в дыхательной цепи, процессах бета-окисления.
Не все ферменты и другие регуляторы, необходимые для эффективного функционирования митохондрий, кодируются митохондриальной ДНК. Большая часть митохондриальных функций контролируется ядерной.
Можно выделить две группы митохондриальных заболеваний:
Ярко выраженные наследственные синдромы, обусловленные мутациями генов, ответственных за митохондриальные белки (синдром Барта, синдром Кернса-Сейра, синдром Пирсона, синдром MELAS, синдром MERRF и другие).
Вторичные митохондриальные заболевания, включающие нарушение клеточного энергообмена как важное звено формирования патогенеза (болезни соединительной ткани, синдром хронической усталости, гликогеноз, кардиомиопатия, мигрень, печёночная недостаточность, панцитопения, а также гипопаратиреоз, диабет, рахит и другие).
Митохондриальные заболевания обусловлены генетическими, структурными, биохимическими дефектами митохондрий, приводящими к нарушениям тканевого дыхания. Они передаются только по женской линии к детям обоих полов, так как сперматозоиды передают зиготе половину ядерного генома, а яйцеклетка поставляет и вторую половину генома, и митохондрии. Патологические нарушения клеточного энергетического обмена могут проявляться в виде дефектов различных звеньев в цикле Кребса, в дыхательной цепи, процессах бета-окисления.
Не все ферменты и другие регуляторы, необходимые для эффективного функционирования митохондрий, кодируются митохондриальной ДНК. Большая часть митохондриальных функций контролируется ядерной.
Можно выделить две группы митохондриальных заболеваний:
Ярко выраженные наследственные синдромы, обусловленные мутациями генов, ответственных за митохондриальные белки (синдром Барта, синдром Кернса-Сейра, синдром Пирсона, синдром MELAS, синдром MERRF и другие).
Вторичные митохондриальные заболевания, включающие нарушение клеточного энергообмена как важное звено формирования патогенеза (болезни соединительной ткани, синдром хронической усталости, гликогеноз, кардиомиопатия, мигрень, печёночная недостаточность, панцитопения, а также гипопаратиреоз, диабет, рахит и другие).
Причины
Повреждение митохондрий в основном возникаетиз-за воздействия реактивных форм кислорода (РФК). В настоящее время считают, что большинство РФК образуется комплексами I и III, вероятно, вследствие высвобождения электронов под воздействием НАД-Н и ФАД-Н в ЦПЭ. Митохондрии используют приблизительно 85% кислорода, потребляемого клеткой, в процессе образования АТФ. В ходе нормального процессаОФ от 0.4% до 4.0% всего употребляемого кислорода преобразуется в митохондриях в супероксидные радикалы (О2-). Супероксид трансформируется до пероксида водорода (Н2О2) с помощью ферментов детоксикации-марганцевой супероксиддисмутазы (Mn-СОД) или цинк/медь- супероксиддисмутазы (Cu/Zn СОД),- а затем до воды с помощью глутатионпероксидазы (ГП) или пероксидредоксина III (ПР III). Однако, если эти ферменты не способны достаточно быстроконвертировать РФК, такие как супероксид-радикал, до воды, происходит оксидативное повреждение и аккумулируется в митохондриях. Глутатион в ПР является одним из основных антиоксидантов в организме. Глутатион представляет собой трипептид, содержащий глутамин, глицин и цистеин. ГП требует селен в качестве кофактора.
Показано, сто супероксид in vitro повреждает железо-серный кластер, находящийся в в активном центре аконитазы, фертента цикла ТКК. Из-за этого железо вступает в реакцию с Н2О2 с образованием гидроксильных радикалов через реакцию Фентона (Fenton). Кроме того, оксид азота (NO) образуется в митохондриях с помощью митохондриальной синтазы оксида азота (МтСОА), а также свободно диффундирует в митохондрии из цитозоля. NO реагирует с O2 с образованием другого радикала- пероксинитрита (ONOO-). Вместе эти два радикала и другие радикалы могут нанести существенное повреждение митохондриям и другим компонентам клетки.
В митохондриях элементами, которые особенно подвержены воздействию свободных радикалов, являются липиды, белки, окислительно-восстановительные ферменты и мтДНК. Прямое повреждение митохондриальных белков снижает их аффинность к субстратам или коферментам и таким образом нарушают их функцию. Проблема осложняется тем, что если повреждение митохондрии произошло, то функция митохондрии может быть скомпрометирована увеличением потребностей клетки для процессов репарации энергии. Митохондриальная дисфункция может привести к цепному процессу, при котором митохондриальное повреждение влечет за собой дополнительное повреждение.
Комплекс I особенно чувствителен к воздействию оксида азота (NO). У животных, которым вводили природные и синтетические антагонисты комплекса I, как правило, наблюдается гибель нейронов. Нарушение функции комплекса I было ассоциировано с наследственной оптической нейропатией Лебера, болезнью Паркинсона и другими нейродегенеративными состояниями.
Гипергликемия индуцирует образование супероксида в митохондриях эндотелиальными клетками, который является важным медиатором диабетических осложнений, таких как сердечно- сосудистые заболевания. Образование супероксида в эндотелии также способствует развитию атеросклероза, гипертензии, сердечной недостаточности, старения, сепсиса, ишемически- реперфузионных повреждений и гиперхолестеринемии.
Медиаторы воспаления, такие как фактор некроза опухолей α (ФНОα) in vitro были связаны с митохондриальной дисфункциейи повышали образование ФРК. В модели застойной сердечной недостаточностидобавление ФНОα к культуре кардиомиоцитов повышало образование РФК и гипертрофию миоцитов. ФНОα вызывает митохондриальную дисфункциюпутем восстановления активности комплекса III в ЦПЭ, увеличивая образование РФК и повреждение мтДНК.
Дефицит питательных веществ или их избыток также может привести к митохондриальной дисфункции. Витамины, минералы и другие метаболиты работают как необходимые кофакторы для синтеза и функционирования митохондриальных ферментов и других составляющих, которые поддерживают функцию митохондрий, и диета с недостатком микрокомпонентов можетускорять старение митохондрий и способствовать нейродегенерации. Например, ферменты участвующие в цепи синтеза гемма, требуют достаточных количеств пиридоксина, железа, меди, цинка и рибофлавина. Недостаток питательных веществ, необходимых для каких- либо компонентов цикла ТКК или ЦПЭ, может привести к увеличению образования свободных радикалов и повреждению мтДНК.
Хорошо известно, что недостаток питательных веществ является широко распространенной причиной патогенеза многих заболеваний и является главным предметом спора в здравоохранении. Недостаток железа главным посредником в развитии общего груза заболеваний, затрагивающих приблизительно 2 миллиарда людей, преимущественно женщин и детей. Это наиболее распространенный тип дефицита питательных веществ. Низкий статус содержания железа снижает активность митохондрийпутем выключения комплекса IV и увеличенияоксидативного стресса. Механизмы, лежащие в основе процесса влияния дефицита питательных веществ (и в некоторых случаях избыток, как при перегрузке железом) на возникновение, развитие и прогрессирование заболеваний, возникающих вследствие нарушения митохондриальных функций, к настоящему времени уже изучены.
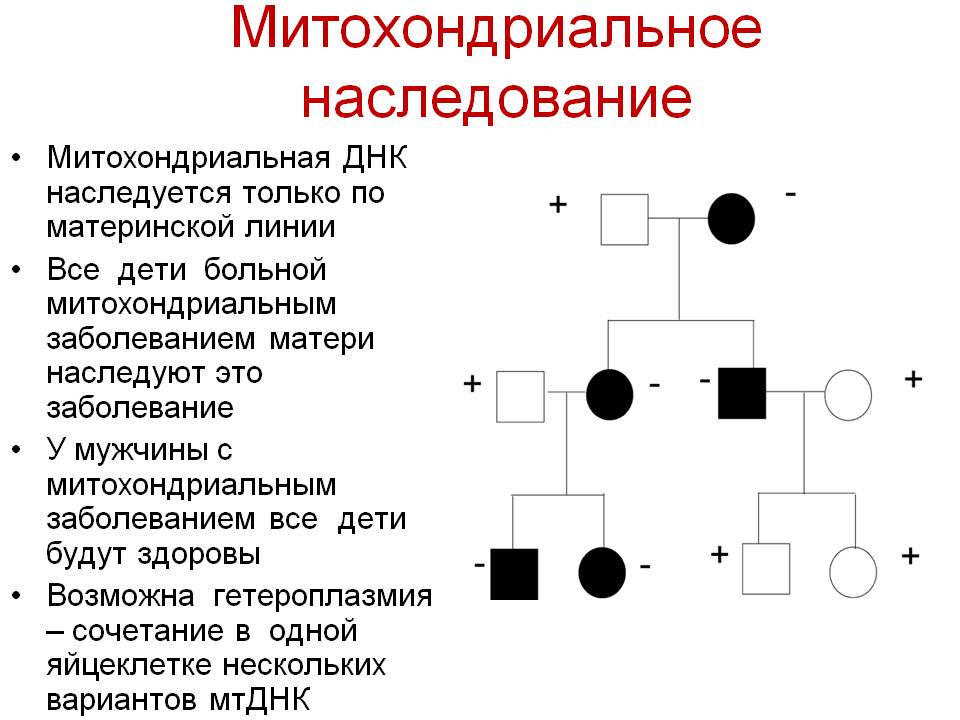
Наследование митохондриальных болезней:
Митохондрии наследуются иначе, чем ядерные гены. Ядерные гены в каждой соматической клетке обычно представлены двумя аллелями (за исключением большинства сцепленных с полом генов у гетерогаметного пола). Один аллель унаследован от отца, другой от матери. Однако митохондрии содержат собственную ДНК, причем в каждой митохондрии человека обычно содержится от 5 до 10 копий кольцевой молекулы ДНК ( Гетероплазмия), и все митохондрии наследуются от матери. Когда митохондрия делится, копии ДНК случайным образом распределяются между ее потомками. Если только одна из исходных молекул ДНК содержит мутацию, в результате случайного распределения такие мутантные молекулы могут накопиться в некоторых митохондриях. Митохондриальная болезнь начинает проявляться в тот момент, когда заметное число митохондрий во многих клетках данной ткани приобретают мутантные копии ДНК (пороговая экспрессия).
Мутации в митохондриальной ДНК происходят, по разным причинам, намного чаще, чем в ядерной. Это означает, что митохондриальные болезни достаточно часто проявляются из-за спонтанных вновь возникающих мутаций. Иногда темп мутирования увеличивается из-за мутаций в ядерных генах, кодирующих ферменты, которые контролируют репликацию ДНК митохондрий.
Показано, сто супероксид in vitro повреждает железо-серный кластер, находящийся в в активном центре аконитазы, фертента цикла ТКК. Из-за этого железо вступает в реакцию с Н2О2 с образованием гидроксильных радикалов через реакцию Фентона (Fenton). Кроме того, оксид азота (NO) образуется в митохондриях с помощью митохондриальной синтазы оксида азота (МтСОА), а также свободно диффундирует в митохондрии из цитозоля. NO реагирует с O2 с образованием другого радикала- пероксинитрита (ONOO-). Вместе эти два радикала и другие радикалы могут нанести существенное повреждение митохондриям и другим компонентам клетки.
В митохондриях элементами, которые особенно подвержены воздействию свободных радикалов, являются липиды, белки, окислительно-восстановительные ферменты и мтДНК. Прямое повреждение митохондриальных белков снижает их аффинность к субстратам или коферментам и таким образом нарушают их функцию. Проблема осложняется тем, что если повреждение митохондрии произошло, то функция митохондрии может быть скомпрометирована увеличением потребностей клетки для процессов репарации энергии. Митохондриальная дисфункция может привести к цепному процессу, при котором митохондриальное повреждение влечет за собой дополнительное повреждение.
Комплекс I особенно чувствителен к воздействию оксида азота (NO). У животных, которым вводили природные и синтетические антагонисты комплекса I, как правило, наблюдается гибель нейронов. Нарушение функции комплекса I было ассоциировано с наследственной оптической нейропатией Лебера, болезнью Паркинсона и другими нейродегенеративными состояниями.
Гипергликемия индуцирует образование супероксида в митохондриях эндотелиальными клетками, который является важным медиатором диабетических осложнений, таких как сердечно- сосудистые заболевания. Образование супероксида в эндотелии также способствует развитию атеросклероза, гипертензии, сердечной недостаточности, старения, сепсиса, ишемически- реперфузионных повреждений и гиперхолестеринемии.
Медиаторы воспаления, такие как фактор некроза опухолей α (ФНОα) in vitro были связаны с митохондриальной дисфункциейи повышали образование ФРК. В модели застойной сердечной недостаточностидобавление ФНОα к культуре кардиомиоцитов повышало образование РФК и гипертрофию миоцитов. ФНОα вызывает митохондриальную дисфункциюпутем восстановления активности комплекса III в ЦПЭ, увеличивая образование РФК и повреждение мтДНК.
Дефицит питательных веществ или их избыток также может привести к митохондриальной дисфункции. Витамины, минералы и другие метаболиты работают как необходимые кофакторы для синтеза и функционирования митохондриальных ферментов и других составляющих, которые поддерживают функцию митохондрий, и диета с недостатком микрокомпонентов можетускорять старение митохондрий и способствовать нейродегенерации. Например, ферменты участвующие в цепи синтеза гемма, требуют достаточных количеств пиридоксина, железа, меди, цинка и рибофлавина. Недостаток питательных веществ, необходимых для каких- либо компонентов цикла ТКК или ЦПЭ, может привести к увеличению образования свободных радикалов и повреждению мтДНК.
Хорошо известно, что недостаток питательных веществ является широко распространенной причиной патогенеза многих заболеваний и является главным предметом спора в здравоохранении. Недостаток железа главным посредником в развитии общего груза заболеваний, затрагивающих приблизительно 2 миллиарда людей, преимущественно женщин и детей. Это наиболее распространенный тип дефицита питательных веществ. Низкий статус содержания железа снижает активность митохондрийпутем выключения комплекса IV и увеличенияоксидативного стресса. Механизмы, лежащие в основе процесса влияния дефицита питательных веществ (и в некоторых случаях избыток, как при перегрузке железом) на возникновение, развитие и прогрессирование заболеваний, возникающих вследствие нарушения митохондриальных функций, к настоящему времени уже изучены.
Наследование митохондриальных болезней:
Митохондрии наследуются иначе, чем ядерные гены. Ядерные гены в каждой соматической клетке обычно представлены двумя аллелями (за исключением большинства сцепленных с полом генов у гетерогаметного пола). Один аллель унаследован от отца, другой от матери. Однако митохондрии содержат собственную ДНК, причем в каждой митохондрии человека обычно содержится от 5 до 10 копий кольцевой молекулы ДНК ( Гетероплазмия), и все митохондрии наследуются от матери. Когда митохондрия делится, копии ДНК случайным образом распределяются между ее потомками. Если только одна из исходных молекул ДНК содержит мутацию, в результате случайного распределения такие мутантные молекулы могут накопиться в некоторых митохондриях. Митохондриальная болезнь начинает проявляться в тот момент, когда заметное число митохондрий во многих клетках данной ткани приобретают мутантные копии ДНК (пороговая экспрессия).
Мутации в митохондриальной ДНК происходят, по разным причинам, намного чаще, чем в ядерной. Это означает, что митохондриальные болезни достаточно часто проявляются из-за спонтанных вновь возникающих мутаций. Иногда темп мутирования увеличивается из-за мутаций в ядерных генах, кодирующих ферменты, которые контролируют репликацию ДНК митохондрий.
|
|
Клиническая картина
Эффекты митохондриальных заболеваний очень разнообразны. Из-за различного распределения дефектных митохондрий в разных органах мутация у одного человека может привести к заболеванию печени, а у другого - к заболеванию мозга. Величина проявления дефекта может быть большой или малой, и она может существенно изменяться, медленно нарастая во времени. Некоторые небольшие дефекты приводят лишь к неспособности пациента выдерживать физическую нагрузку, соответствующую его возрасту, и не сопровождаются серьёзными болезненными проявлениями. Другие дефекты могут быть более опасны, приводя к серьёзной патологии.
В общем случае митохондриальные заболевания проявляются сильнее при локализации дефектных митохондрий в мышцах, мозге, нервной ткани, поскольку эти органы требуют больше всего энергии для выполнения соответствующих функций.
Несмотря на то, что протекание митохондриальных заболеваний сильно отличаются у разных пациентов, на основании общих симптомов и конкретных мутаций, вызывающих болезнь, выделено несколько основных классов этих заболеваний.
Помимо относительно распространённой митохондриальной миопатии, встречаются:
1. Митохондриальный сахарный диабет, сопровождающийся глухотой (DAD, MIDD, синдром MELAS) - это сочетание, проявляющееся в раннем возрасте, может быть вызвано мутацией митохондриального гена MT-TL1, но сахарный диабет и глухота могут быть вызваны как митохондриальными заболеваниями, так и иными причинами;
2. Наследственная оптическая нейропатия Лебера, характеризующийся потерей зрения в раннем пубертатном периоде;
3. Синдром Вольфа-Паркинсона-Уайта;
4. Рассеянный склероз и подобные ему заболевания;
5. Синдром Лея (Leigh) или подострая некротизирующая энцефаломиопатия : после начального нормального постнатального развития болезнь проявляется обычно в конце первого года жизни, иногда - во взрослом возрасте. Болезнь сопровождается быстрой потерей функций организма и характеризуется судорогами, нарушенным состоянием сознания, деменцией, остановкой дыхания;
6. Нейропатия, атаксия, retinitis pigmentos и птоз: прогрессирующие симптомы нейропатии, атаксии, туннельное зрение и потеря зрения, птоз, деменция;
7. Митохондриальная нейрогастроинтенстинальная энцефалопатия: гастроинтестинальная псевдообструкция и кахексией, нейропатия, энцефалопатия с изменениями белого вещества головного мозга.
Ассоциированные симптомы: Миоклония. Судороги в ногах. Тонико-клонические судороги.
В общем случае митохондриальные заболевания проявляются сильнее при локализации дефектных митохондрий в мышцах, мозге, нервной ткани, поскольку эти органы требуют больше всего энергии для выполнения соответствующих функций.
Несмотря на то, что протекание митохондриальных заболеваний сильно отличаются у разных пациентов, на основании общих симптомов и конкретных мутаций, вызывающих болезнь, выделено несколько основных классов этих заболеваний.
Помимо относительно распространённой митохондриальной миопатии, встречаются:
1. Митохондриальный сахарный диабет, сопровождающийся глухотой (DAD, MIDD, синдром MELAS) - это сочетание, проявляющееся в раннем возрасте, может быть вызвано мутацией митохондриального гена MT-TL1, но сахарный диабет и глухота могут быть вызваны как митохондриальными заболеваниями, так и иными причинами;
2. Наследственная оптическая нейропатия Лебера, характеризующийся потерей зрения в раннем пубертатном периоде;
3. Синдром Вольфа-Паркинсона-Уайта;
4. Рассеянный склероз и подобные ему заболевания;
5. Синдром Лея (Leigh) или подострая некротизирующая энцефаломиопатия : после начального нормального постнатального развития болезнь проявляется обычно в конце первого года жизни, иногда - во взрослом возрасте. Болезнь сопровождается быстрой потерей функций организма и характеризуется судорогами, нарушенным состоянием сознания, деменцией, остановкой дыхания;
6. Нейропатия, атаксия, retinitis pigmentos и птоз: прогрессирующие симптомы нейропатии, атаксии, туннельное зрение и потеря зрения, птоз, деменция;
7. Митохондриальная нейрогастроинтенстинальная энцефалопатия: гастроинтестинальная псевдообструкция и кахексией, нейропатия, энцефалопатия с изменениями белого вещества головного мозга.
Ассоциированные симптомы: Миоклония. Судороги в ногах. Тонико-клонические судороги.
Лечение
В настоящее время лечение митохондриальных заболеваний находится в стадии разработки, но распространённым терапевтическим методом служит симптоматическая профилактика с помощью витаминов. В частности, в лечении синдрома MELAS у ряда пациентов оказались эффективными кофермент Q, который применяется как цитопротектор и антиоксидант при кардиомиопатиях и хронической сердечной недостаточности, рибофлавин и никотинамид. Также в качестве одного из методов применяются пируваты.
В настоящее время проводятся экспериментальные работы по изучению возможности экстракорпорального (in vitro) оплодотворения с использованием химерной яйцеклетки, ядро которой получено из яйцеклетки пациентки с митохондриальным заболеванием, а цитоплазму из другой яйцеклетки от женщины с нормально функционирующими митохондриями (замена ядра).
В настоящее время проводятся экспериментальные работы по изучению возможности экстракорпорального (in vitro) оплодотворения с использованием химерной яйцеклетки, ядро которой получено из яйцеклетки пациентки с митохондриальным заболеванием, а цитоплазму из другой яйцеклетки от женщины с нормально функционирующими митохондриями (замена ядра).