ICD-10 codes
Introduction
МКБ 10:
L44.0.
Год утверждения (частота пересмотра):
2016 (1 раз в 3 года).
ID:
КР195.
URL:
Профессиональные ассоциации:
• Российское общество дерматовенерологов и косметологов.
Утверждены.
Российским обществом дерматовенерологов и косметологов на XVI Всероссийском Съезде дерматовенерологов и косметологов (Москва, 16 июня 2016 г.
Согласованы.
Научным советом Министерства Здравоохранения Российской Федерации.
L44.0.
Год утверждения (частота пересмотра):
2016 (1 раз в 3 года).
ID:
КР195.
URL:
Профессиональные ассоциации:
• Российское общество дерматовенерологов и косметологов.
Утверждены.
Российским обществом дерматовенерологов и косметологов на XVI Всероссийском Съезде дерматовенерологов и косметологов (Москва, 16 июня 2016 г.
Согласованы.
Научным советом Министерства Здравоохранения Российской Федерации.
Professional associations
• Российское общество дерматовенерологов и косметологов.
 List of abbreviations
List of abbreviations
ВИЧ - вирус иммунодефицита человека.
МКБ - Международная классификация болезней.
ПКВО - питириаз красный волосяной отрубевидный.
МКБ - Международная классификация болезней.
ПКВО - питириаз красный волосяной отрубевидный.
Terms and definitions
Питириаз красный волосяной отрубевидный (ПКВО, лишай красный волосяной отрубевидный, болезнь Девержи) - воспалительное заболевание кожи, обусловленное нарушением ороговения и проявляющееся фолликулярными гиперкератотическими папулами, шелушащимися бляшками оранжево-красного цвета и ладонно-подошвенным гиперкератозом.
Description
Питириаз красный волосяной отрубевидный (ПКВО, лишай красный волосяной отрубевидный, болезнь Девержи) - воспалительное заболевание кожи, обусловленное нарушением ороговения и проявляющееся фолликуллярными гиперкератотическими папулами, шелушащимися бляшками оранжево-красного цвета и ладонно-подошвенным гиперкератозом.
Reasons
Этиология и патогенез ПКВО неизвестны. В качестве возможного этиологического фактора болезни рассматриваются нарушения метаболизма витамина А и связь с аутоиммунными заболеваниями. Предполагается развитие патологического иммунного ответа на неизвестные антигены, нарушающего передачу сигнала ретиноидов в эпидермисе и в итоге - терминальную дифференцировку кератиноцитов [1]. Полагают, что в основе развития болезни лежит дефект синтеза ретинол-связывающего белка - специфического белка-переносчика витамина А [2].
Описаны семейные случаи ПКВО с аутосомно-доминантным и аутосомно-рецессивным наследованием заболевания [3-5].
В ряде случаев развитие ПКВО ассоциировано с инфекциями и злокачественными новообразованиями внутренних органов [6]. К вероятным триггерным факторам заболевания относят стрептококковую инфекцию, цитомегаловирус, вирус Varicella zoster, ВИЧ. Имеются данные об ассоциации ПКВО с раком почки, раком из клеток Меркеля, плоскоклеточным раком, аденокарциномой, раком печени, раком гортани.
Описаны семейные случаи ПКВО с аутосомно-доминантным и аутосомно-рецессивным наследованием заболевания [3-5].
В ряде случаев развитие ПКВО ассоциировано с инфекциями и злокачественными новообразованиями внутренних органов [6]. К вероятным триггерным факторам заболевания относят стрептококковую инфекцию, цитомегаловирус, вирус Varicella zoster, ВИЧ. Имеются данные об ассоциации ПКВО с раком почки, раком из клеток Меркеля, плоскоклеточным раком, аденокарциномой, раком печени, раком гортани.
Epidemiology
ПКВО - редкое заболевание. В Российской Федерации статистический учет больных ПКВО не ведется. Оценивается, что примерно 1 пациент из 5000, обращающихся впервые к дерматовенерологу в связи с заболеванием кожи - это больной ПКВО [7]. Заболеванием в равной степени страдают мужчины и женщины всех рас. Имеется 2 возрастных пика заболеваемости ПКВО - первое и пятое десятилетия жизни.
Classification
С учетом возраста начала заболевания, его клинического течения и прогноза выделяют 6 типов ПКВО [8].
• ПКВО I типа (классический взрослый) наблюдается в 55% случаев ПКВО;
• ПКВО II типа (атипичный взрослый) наблюдается в 5% случаях заболевания;
• ПКВО III типа (классический ювенильный) наблюдается в 10% случаях заболевания;
• ПКВО IV типа (ограниченный ювенильный) наблюдается в 25% случаях заболевания;
• ПКВО V типа (атипичный ювенильный) наблюдается в 5% случаях заболевания;
• ПКВО VI типа (ВИЧ-ассоциированный) - данные о его распространенности вариабельны.
• ПКВО I типа (классический взрослый) наблюдается в 55% случаев ПКВО;
• ПКВО II типа (атипичный взрослый) наблюдается в 5% случаях заболевания;
• ПКВО III типа (классический ювенильный) наблюдается в 10% случаях заболевания;
• ПКВО IV типа (ограниченный ювенильный) наблюдается в 25% случаях заболевания;
• ПКВО V типа (атипичный ювенильный) наблюдается в 5% случаях заболевания;
• ПКВО VI типа (ВИЧ-ассоциированный) - данные о его распространенности вариабельны.
Symptoms
Классический ПКВО взрослых (тип I) характеризуется фолликулярными папулами и эритематозными бляшками с желтовато-оранжевым оттенком, которые сливаются на многих участках кожи туловища. В очагах поражения кожи может определяться симптом терки, когда при пальпации пораженной кожи ощущается ее шероховатость. В пределах распространенной эритемы обычно располагаются островки видимо здоровой кожи. В тяжелых случаях развивается эритродермия. Ладонно-подошвенная кератодермия отличается заметным желтовато-оранжевым оттенком, развивается в течение нескольких недель и сопровождается поражением ногтей. На высоте развития ПКВО I типа часто сопровождается возникновением эктропиона.
Атипичный ПКВО взрослых (тип II) своими клиническими проявлениями напоминает вульгарный ихтиоз. У пациентов может наблюдаться разрежение волос на волосистой части головы. Выражен ладонно-подошвенный гиперкератоз, который проявляется пластинчатым шелушением.
Классический ювенильный ПКВО (тип III) сходен по клиническим проявлениям с классическим ПКВО взрослых, от которого отличается только возрастом начала болезни и особенностями течения.
Ограниченный ювенильный ПКВО (тип IV) характеризуется четко ограниченными участками эритемы и фолликулярного гиперкератоза, которые преимущественно располагаются на коленях и локтях. На других участках тела высыпания менее выражены. Для этого типа болезни характерно поражение ладоней и подошв, однако оно может и отсутствовать.
Атипичный ювенильный ПКВО (тип V) преимущественно гиперкератотическими фолликулярными высыпаниями и ихтиозиформным поражением кожи. У части пациентов развиваются склеродермоподобные изменения на ладонях и подошвах.
ВИЧ-ассоциированный ПКВО (тип VI) отличается разнообразием клинических проявлений. Обычно он начинается с появления симметрично располагающихся на разгибательных поверхностях конечностей эритематозных шелушащихся фолликулярных папул. У больных ВИЧ-ассоциированным типом болезни обычным проявлением ПКВО являются выраженные фолликулярные роговые пробки с формированием шипиков, которые реже встречаются при классическом I типе. Выраженность поражения ладоней, подошв и ногтей варьирует в широких пределах, но может отсутствовать. Частым проявлением заболевания является эритродермия, но на ее фоне также встречаются островки непораженной кожи. В отличие от классического I типа болезни роговые пробки и шипики не склонны к регрессу. ВИЧ-ассоциированный ПКВО может быть протекать на фоне конглобатных угрей, гидраденита и шиповатого лишая. В связи с этим такие клинические проявления называют ВИЧ-ассоциированным фолликулярным синдромом [9-11].
Возможно существование промежуточных типов ПКВО, в связи с чем тип заболевания может быть определен не всегда.
Атипичный ПКВО взрослых (тип II) своими клиническими проявлениями напоминает вульгарный ихтиоз. У пациентов может наблюдаться разрежение волос на волосистой части головы. Выражен ладонно-подошвенный гиперкератоз, который проявляется пластинчатым шелушением.
Классический ювенильный ПКВО (тип III) сходен по клиническим проявлениям с классическим ПКВО взрослых, от которого отличается только возрастом начала болезни и особенностями течения.
Ограниченный ювенильный ПКВО (тип IV) характеризуется четко ограниченными участками эритемы и фолликулярного гиперкератоза, которые преимущественно располагаются на коленях и локтях. На других участках тела высыпания менее выражены. Для этого типа болезни характерно поражение ладоней и подошв, однако оно может и отсутствовать.
Атипичный ювенильный ПКВО (тип V) преимущественно гиперкератотическими фолликулярными высыпаниями и ихтиозиформным поражением кожи. У части пациентов развиваются склеродермоподобные изменения на ладонях и подошвах.
ВИЧ-ассоциированный ПКВО (тип VI) отличается разнообразием клинических проявлений. Обычно он начинается с появления симметрично располагающихся на разгибательных поверхностях конечностей эритематозных шелушащихся фолликулярных папул. У больных ВИЧ-ассоциированным типом болезни обычным проявлением ПКВО являются выраженные фолликулярные роговые пробки с формированием шипиков, которые реже встречаются при классическом I типе. Выраженность поражения ладоней, подошв и ногтей варьирует в широких пределах, но может отсутствовать. Частым проявлением заболевания является эритродермия, но на ее фоне также встречаются островки непораженной кожи. В отличие от классического I типа болезни роговые пробки и шипики не склонны к регрессу. ВИЧ-ассоциированный ПКВО может быть протекать на фоне конглобатных угрей, гидраденита и шиповатого лишая. В связи с этим такие клинические проявления называют ВИЧ-ассоциированным фолликулярным синдромом [9-11].
Возможно существование промежуточных типов ПКВО, в связи с чем тип заболевания может быть определен не всегда.
Diagnostics
2,1 Жалобы и анамнез.
Больные ПКВО предъявляют жалобы на ограниченные или распространенные высыпания, которые могут сопровождаться зудом.Классический ПКВО взрослых (тип I) обычно начинается с появления на коже лица, волосистой части головы и верхней половины тела эритематозных пятен. Затем, в течение нескольких недель или месяцев высыпания распространяются на нижнюю часть тела. Этот тип заболевания характеризуется хорошим прогнозом. Несмотря на тяжесть заболевания, которая может сопровождаться нарушением трудоспособности, более, чем у 80% больных в течение 3 лет наступает полная ремиссия.
Атипичный ПКВО взрослых (тип II) характеризуется длительным (до 20 и более лет) течением.
Классический ювенильный ПКВО (тип III) начинается обычно в возрасте от 5 до 10 лет. Первые высыпания у детей, как правило, локализуются на нижней части тела и затем распространяются вверх. Течение заболевания у детей более благоприятно, чем у взрослых, так как спонтанное разрешение высыпаний наблюдается в течение 1 года после начала заболевания. Описаны семейные случаи III типа ПКВО.
Ограниченный ювенильный ПКВО (тип IV) начинается чаще в возрасте 3-10 лет и наблюдается у детей препубертатного возраста и лиц молодого возраста. Высыпания обычно остаются ограниченными, заболевание не переходит в классический тип ПКВО с распространенным поражением кожи. Наступление ремиссии в течение 3 лет от начала болезни отмечается у 30-32% больных этим типом ПКВО, что значительно реже по сравнению с классическим типом ПКВО взрослых. Заболевание может характеризоваться минимальными проявлениями, но возможно также течение болезни с выраженными обострениями и ремиссиями.
Атипичный ювенильный ПКВО (тип V) характеризуется ранним возрастом начала (0 - 4 года) и хроническим течением заболевания. Большинство семейных случаев ПКВО относятся к V типу заболевания.
ПКВО часто резистентен к проводимой терапии, однако возможно развитие спонтанных ремиссий.
ВИЧ-ассоциированный ПКВО (тип VI) отличается более неблагоприятным прогнозом по сравнению ПКВО I типа. ПКВО может быть первым проявлением ВИЧ-инфекции.
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
2,2 Физикальное обследование.
Рекомендуется визуальное исследование кожи и ее придатков.Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Во время визуального исследования кожи и ее придатков оценивается характер высыпаний, их локализация, определяется наличие «островков видимо здоровой кожи», поражения ногтей, эктропиона.
Рекомендуется пальпация кожи в очагах поражения.
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Во время пальпации оценивается консистенция пораженной кожи, наличие симптома терки, при котором определяется шероховатость кожи в очагах поражения.
2,3 Лабораторная диагностика.
Рекомендуется подтверждать диагноз ПКВО гистологическим исследованием биоптата кожи из очага поражения.Комментарии. Гистологическими признаками ПКВО являются акантоз с ортокератозом и паракератозом при сохраненном зернистом слое. Волосяные фолликулы расширены, присутствуют роговые пробки. В подлежащей дерме часто присутствует поверхностный периваскулярный и перифолликулярный инфильтрат. Типичные гистологические признаки ПКВО обнаруживаются в 38% случаев [12]. Отсутствие гистологических признаков ПКВО при исследовании биоптата пораженной кожи не исключает диагноза ПКВО, который в данном случае основывается на клинической картине болезни, и может потребовать повторного проведения гистологических исследований биоптатов кожи [12].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
2,4 Инструментальная диагностика.
Не применяется.2,5 Иная диагностика.
• Рекомендуется консультация терапевта, эндокринолога при планировании лечения методом фототерапии для исключения противопоказаний к ее проведению.Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
• Рекомендуется консультация акушера-гинеколога при планировании лечения методом фототерапии женщинам для исключения противопоказаний к ее проведению.
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
• Рекомендуется консультация офтальмолога при планировании лечения методом ПУВА-терапии для исключения противопоказаний к ее проведению.
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Treatment
3,1 Консервативное лечение.
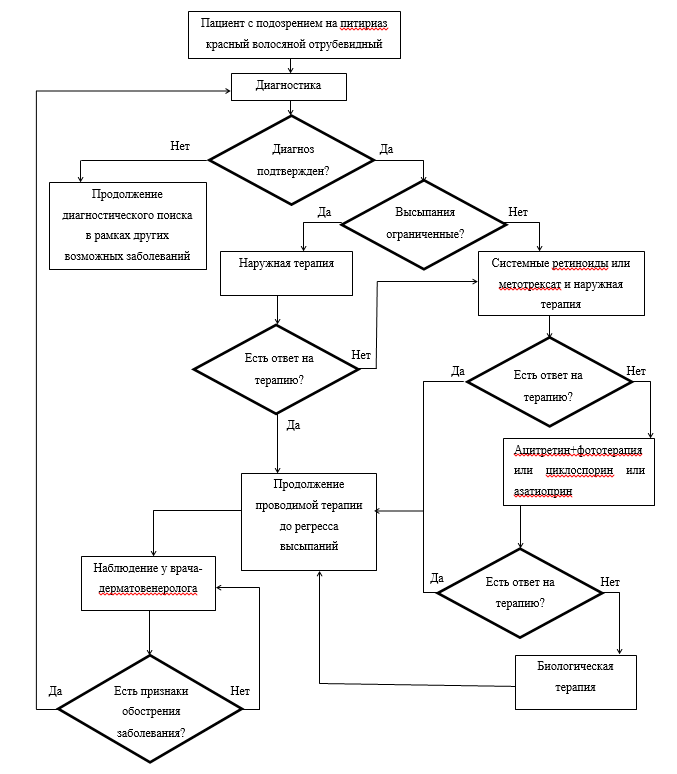
Рекомендуется системная и наружная терапия больных ПКВО [6].Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Для системной терапии используются препараты из группы ретиноидов (ацитретин, изотретиноин), антиметаболиты (метотрексат), иммунодепрессанты (циклоспорин, азатиоприн, инфликсимаб, этанерцепт, адалимумаб). Заболевание часто резистентно к проводимой терапии, однако возможно развитие спонтанных ремиссий. Наружная терапия может быть достаточной для больных ПКВО с ограниченными высыпаниями. Больным с распространенным поражением кожи наружная терапия проводится в сочетании с системной терапией для уменьшения частоты развития и выраженности побочного действия лекарственного препарата для системной терапии. Для выявления заболеваний и состояний, являющихся противопоказаниями к проведению системной терапии ПКВО, перед началом лечения и для выявления нежелательных явлений, ассоциированных с проводимой терапией, необходим контроль состояния больных, что зависит от используемых методов лечения.
• Рекомендуется наносить на очаги поражения:
Эмоленты 2 раза в день [7, 13 -15].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
2% салициловая кислота** 2 раза в день [7].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 3).
• Рекомендуется наносить на очаги поражения при ограниченных высыпаниях:
Пимекролимус** 1% крем 1 раз в день 20 г в день, при массе тела менее 45 кг - 10 г в день (в инструкции по медицинскому применению пимекролимуса ПКВО не включен в показания к применению препарата) [15].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 3).
Или.
Кальципотриол 50 мкг/г 2 раза в день в течение 2-10 месяцев (в инструкции по медицинскому применению кальципотриола ПКВО не включен в показания к применению препарата) [16].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 3).
• Рекомендуется наносить на очаги поражения при распространенных высыпаниях:
Топические глюкокортикостероидные препараты .[12, 17].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 3).
• Для системной терапии взрослых рекомендуются:
Ацитретин 25-50 мг в сутки перорально, длительность терапии определяется характером патологического процесса [13].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 3).
Комментарии. Перед назначением ацитретина и во время терапии ацитретином необходимо проводить контроль состояния больных. Следует контролировать функцию печени перед началом лечения ацитретином, каждые 1-2 недели в течение первого месяца после начала лечения, а затем - через каждые 3 месяца. Если результаты анализов указывают на патологию, контроль следует проводить еженедельно. Если функция печени не нормализуется или ухудшается, препарат следует отменить. В этом случае рекомендуется продолжать контролировать функцию печени на протяжении, по крайней мере, 3 месяцев.
Необходимо контролировать уровень холестерина и триглицеридов сыворотки натощак.
У больных сахарным диабетом ацитретин может ухудшить толерантность к глюкозе, поэтому на ранних этапах лечения концентрацию глюкозы в крови следует проверять чаще обычного.
Из-за возможности нарушения ночного зрения необходим тщательный мониторинг за нарушением зрения.
В связи с высокой тератогенностью ацитретина за 2 недели до начала лечения должен быть получен отрицательный результат обследования на беременность. Во время лечения рекомендуется проводить дополнительные обследования на беременность не реже 1 раза в месяц. Абсолютно необходимо, чтобы каждая женщина, способная к деторождению, применяла эффективные противозачаточные средства без перерывов в течение 4 недель до начала лечения, в процессе лечения и в течение двух лет после завершения лечения ацитретином. Ацитретин нельзя назначать кормящим матерям.
Или.
Изотретиноин 1 мг на кг массы тела в сутки перорально в течение 12-26 недель (в инструкции по медицинскому применению изотретиноина ПКВО не включен в показания к применению препарата) [12, 18-20].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 3).
Комментарии. Перед назначением изотретиноина и во время терапии изотретиноином необходимо проводить контроль состояния больных.
Проводится контроль функции печени и уровня печеночных ферментов в крови до лечения, через 1 месяц после начала терапии, а затем каждые 3 месяца или по показаниям. Если уровень печеночных трансаминаз превышает норму, необходимо уменьшить дозу препарата или отменить его.
Следует определять уровень липидов в сыворотке натощак до лечения, через 1 месяц после начала терапии, а затем каждые 3 месяца или по показаниям. Необходимо контролировать уровень триглицеридов в сыворотке крови, поскольку клинически значимое повышение их уровня выше 800 мг/дл или 9 ммоль/л может сопровождаться развитием острого панкреатита, возможно с летальным исходом. При стойкой гиперлипидемии или симптомах панкреатита изотретиноин следует отменить.
При сахарном диабете, ожирении, алкоголизме или нарушениях липидного обмена рекомендуется более частый контроль лабораторных показателей. При сахарном диабете или подозрении на него необходимо строго контролировать уровень глюкозы в плазме.
В связи с тем, что на фоне приема изотретиноина возможно снижение остроты зрения, развитие кератита, сухости конъюнктивы, больных, предъявляющих жалобы на зрение, следует направлять к офтальмологу и рассмотреть вопрос об отмене препарата.
Абсолютное противопоказание для терапии изотретиноином - беременность. У женщин должен быть получен отрицательный результат достоверного теста на беременность в пределах 11 дней до начала приема препарата. Тест на беременность рекомендуется проводить ежемесячно во время лечения и через 5 недель после окончания лечения. Рекомендуется во время терапии изотретиноином использовать противозачаточные средства.
Или.
Метотрексат** 5-30 мг в неделю (в инструкции по медицинскому применению метотрексата ПКВО не включен в показания к применению препарата. [19, 21].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 3).
Комментарии. Перед назначением метотрексата и во время лечения метотрексатом проводится контроль состояния больного.
С целью своевременного выявления побочных явлений необходимо контролировать состояние периферической крови, для чего 1 раз в неделю проводится общий анализ крови с определением количества лейкоцитов и тромбоцитов. Необходимо контролировать активность печеночных трансаминаз, функцию почек, по необходимости проводить рентгенологическое исследование органов грудной клетки. Терапию метотрексатом прекращают, если число лейкоцитов в крови составляет менее 1,5x109/л, количество нейтрофилов - менее 0,2x109/л, количество тромбоцитов менее 75x109/л. Повышение уровня креатинина на 50% и более первоначального содержания требует повторного измерения уровня креатинина. Возрастание уровня билирубина требует интенсивной дезинтоксикационной терапии.
При развитии диареи и язвенного стоматита терапию метотрексатом необходимо прервать. При появлении признаков пульмональной токсичности (особенно сухой кашель без мокроты) лечение метотрексатом рекомендуется прекратить. Появление признаков угнетения функции костного мозга, необычных кровотечений или кровоизлияний, черного дегтеобразного стула, крови в моче или кале или точечных красных пятен на коже требует немедленной консультации врача.
Мужчинам и женщинам детородного возраста во время лечения метотрексатом и как минимум в течение 3 месяцев после следует применять надежные методы контрацепции.
Для снижения вероятности развития нежелательных явлений лечение метотрексатом должно сопровождаться терапией препаратом фолиевой кислоты перорально 5 мг 1 раз в неделю через 1-3 дня после приема метотрексата.
• При неэффективности ацитретина, изотретиноина и метотрексата рекомендуется:
Ацитретин 25 мг в сутки перорально + ультрафиолетовая терапия дальнего длинноволнового диапазона (УФА-1), 15 процедур 5 раз в неделю в первоначальной дозе 30 Дж/см2 с повышением до 60 Дж/см2 на 2-ой день, до 90 Дж/см2 на 3-7-ой дни и до 100 Дж/см2 на 8-15 дни [22].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 3).
Или.
Ацитретин 50 мг в сутки перорально с постепенным снижением до 25 мг в сутки + ПУВА-терапия в начальной дозе УФА 0,5 Дж/см2 и последующим ее повышением на 0,3 Дж/см2 каждый 3-ий день до максимальной дозы 1,8 Дж/см2 с внутренним применением фотосенсибилизаторов - метоксалена перорально 0,5 мг/кг массы тела (Ре-ПУВА) [23].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 3).
Или.
Циклоспорин** первоначально 5 мг/кг массы тела в сутки перорально в течение 2-4 недель с последующим постепенным снижением дозы до 2-3 мг/кг массы тела в день, продолжая терапию в течение 12-20 недель (в инструкции по медицинскому применению циклоспорина ПКВО не включен в показания к применению препарата) [24, 25].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 3).
Комментарии. Перед назначением циклоспорина и во время лечения циклоспорином следует контролировать состояния больного. Необходим регулярный контроль концентрации креатинина плазмы - повышение может свидетельствовать о нефротоксическом действии и потребовать снижения дозы: на 25% при возрастании уровня креатинина более чем на 30% от исходного, и на 50%, если уровень его повышается вдвое. Если уменьшение дозы в течение 4 недель не приводит к снижению уровня креатинина, циклоспорин отменяют. Рекомендуется мониторинг артериального давления, содержания в крови калия, мочевой кислоты, билирубина, трансаминаз, липидного профиля.
Или.
Азатиоприн** 150-200 мг в сутки перорально в течение не менее 2 месяцев (в инструкции по медицинскому применению азатиоприна ПКВО не включен в показания к применению препарата. [26].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 3).
Комментарии. Перед назначением азатиоприна и во время лечения азатиоприном проводится контроль состояния больного.
В период лечения женщины детородного возраста должны использовать надежные методы контрацепции.
В течение первых 8 недель лечения должен еженедельно проводиться клинический анализ крови, включая определение тромбоцитов (в последующем - 1-2 раза в месяц), а также периодический контроль активности сывороточных печеночных трансаминаз, щелочной фосфатазы и уровня билирубина.
В дальнейшем анализы крови можно контролировать реже, но клинический анализ крови с определением тромбоцитов нужно проводить ежемесячно или по крайней мере с интервалом не более 3 месяцев.
Пациенты, получающие азатиоприн, должны быть проинструктированы о необходимости немедленно сообщать обо всех случаях инфекций, появления неожиданных кровоподтеков, кровотечения или других признаков угнетения костного мозга.
• При тяжелом течении, резистентном к терапии, для лечения взрослых больных рекомендуются биологические препараты иммунодепрессанты:
Инфликсимаб** 5 мг на кг массы тела внутривенно. Инфузии проводятся в недели 0 и 2, после чего при развитии улучшении состояния больного в виде регресса высыпаний на 75% и более проводятся инфузии инфликсимаба через 6 недель после первой инфузии и далее 1 раз в 8 недель (в инструкции по медицинскому применению инфликсимаба ПКВО не включен в показания к применению препарата) [27-30].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 3).
Или.
Инфликсимаб** 5 мг на кг массы тела внутривенно по схеме: 0, 2, 6 недели, затем 1 раз в 8 недель в комбинации с метотрексатом 10-30 мг/неделю (в инструкции по медицинскому применению инфликсимаба и метотрексата ПКВО не включен в показания к применению препарата) [27, 31].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 3).
Или.
Инфликсимаб** 5 мг на кг массы тела внутривенно по схеме: 0, 2, 6 недели, затем 1 раз в 8 недель в комбинации с ацитретином 50 мг в сутки (в инструкции по медицинскому применению инфликсимаба ПКВО не включен в показания к применению препарата)[29, 32].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 3).
Или.
Этанерцепт** 25-50 мг подкожно 2 раза в неделю на протяжении до 9 месяцев (в инструкции по медицинскому применению этанерцепта ПКВО не включен в показания к применению препарата)[33, 34].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 3).
Или.
Этанерцепт** 50 мг подкожно 2 раза в неделю в сочетании с ацитретином 0,2 мг/кг массы тела в сутки в течение 12-48 недель (в инструкции по медицинскому применению этанерцепта ПКВО не включен в показания к применению препарата) [35].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 3).
Или.
Адалимумаб** в первоначальной дозе 80 мг подкожно, через 1 неделю - 40 мг, затем по 40 мг 1 раз в 2 недели в течение 32 недель. Эффект отмечается на 3-6-ой неделе терапии, полный регресс высыпаний возможен на 4-8-ой неделе терапии (в инструкции по медицинскому применению адалимумаба ПКВО не включен в показания к применению препарата) [36, 37].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 3).
• Комментарии. Перед началом биологической терапии препаратами инфликсимаб, этанерцепт, адалимумаб необходимо проведение следующих исследований:
• клинический анализ крови, включая определение лейкоцитарной формулы и количества тромбоцитов;
• биохимический анализ крови общетерапевтический, включая исследование уровня креатинина, мочевины, билирубина, определение активности аспартатаминотрансферазы, аланинаминотрансферазы, гамма-глютамилтрансферазы и щелочной фосфатазы;
• общий анализ мочи;
• рентгенография органов грудной клетки в 2 проекциях, туберкулиновые пробы, консультация фтизиатра для исключения туберкулезной инфекции;
• обследование на ВИЧ-инфекцию, вирусные гепатиты В и С;
• тест на беременность.
Биологическая терапия не рекомендуется во время беременности. В связи с этим перед началом биологической терапии женщинам детородного возраста необходимо получить отрицательный результат теста на беременность. При проведении биологической терапии и, по меньшей мере, 6 месяцев после ее окончания женщины детородного возраста должны использовать надежные методы контрацепции.
В процессе биологической терапии проводится мониторинг нежелательных явлений и контроль лабораторных показателей:
• клиническая оценка состояния больного - каждые 3-6 месяцев;
• осмотр невролога каждые 3-6 месяцев для выявления проявлений неврологических, в том числе демиелинизирующих, заболеваний;
• консультация кардиолога каждые 3-6 месяцев для выявления признаков сердечно-сосудистой недостаточности;
• консультация фтизиатра 2 раза в год для исключения развития туберкулеза;
• клинический анализ крови 1 раз в 3-6 месяцев (для инфликсимаба - перед каждым внутривенным введением);
• биохимический анализ крови (исследование уровня креатинина, мочевины, билирубина, определение активности аспартатаминотрансферазы, аланинаминотрансферазы, гамма-глютамилтрансферазы и щелочной фосфатазы в крови) 1 раз в 3-6 месяцев (для инфликсимаба - перед каждым внутривенным введением);
• общий анализ мочи 1 раз в 3-6 месяцев (для инфликсимаба - перед каждым внутривенным введением);
• анализ крови на гепатит В, С и ВИЧ-инфекцию - через каждые 6 месяцев;
• тест на беременность (для инфликсимаба - перед каждым внутривенным введением), а также при вероятности наступившей беременности;
• рентгенография органов грудной клетки 2 раза в год;
• ультразвуковое исследование органов брюшной полости, органов малого таза, предстательной железы по показаниям.
• Для системной терапии детей, больных ПКВО, рекомендуется:
Ацитретин 0,5 мг на кг массы тела в сутки перорально в сочетании с ультрафиолетовой узкополосной средневолновой терапией с длиной волны 311 нм - 25 процедур [38].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 3).
Комментарии. При назначении ацитретина детям нужно внимательно следить за параметрами роста и развития костей.
Или.
Изотретиноин 0,5-1 мг на кг массы тела в сутки перорально только детям в возрасте 12 лет и старше (в инструкции по медицинскому применению изотретиноина ПКВО не включен в показания к применению препарата) [17, 39].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 3).
Комментарии. Изотретиноин противопоказан детям в возрасте до 12 лет.
• В тяжелых случаях ПКВО у детей, резистентных к терапии, рекомендуется:
Циклоспорин** 3,0 мг на кг массы тела в сутки перорально в течение 5 недель, затем проводится постепенно снижение дозы препарата до его полной отмены в течение 18 недель (в инструкции по медицинскому применению циклоспорина ПКВО не включен в показания к применению препарата) [40].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 3).
3,2 Хирургическое лечение.
Не применяется.3,3 Иное лечение.
Не применяется.Rehabilitation and outpatient treatment
Методы реабилитации больных ПКВО не разработаны.
Prevention
Методы профилактики ПКВО не разработаны.
Criteria for assessing the quality of medical care
| №№ | Критерии качества | Уровень достоверности доказательств | Уровень убедительности доказательств |
| 1 | Выполнен общий (клинический) анализ крови развернутый | 4 | D |
| 2 | Выполнен анализ крови биохимический (исследование уровня общего белка, глюкозы, креатинина, мочевой кислоты, билирубина общего, холестерина общего, триглицеридов, аланин-аминотрансферазы, аспартат-аминотрансферазы) | 4 | D |
| 3 | Выполнен общий нализ мочи | 4 | D |
| 4 | Проведена терапия системными ретиноидами и/или метотрексатом и/или иммунодепрессантами и/или фототерапия и/или лекарственными препаратами группы топические глюкокортикостероиды (в зависимости от медицинских показаний и при отсутствии медицинских противопоказаний) | 4 | D |
| 5 | Достигнут частичный или полный регресс высыпаний | 4 | D |
References
• Magro с.M., сrowson A.N. The clinical and histomorphological features of pityriasis rubra pilaris. J сutan Pathol 1997; №24 (7): 416-424.
• Finzi A.F., Altomare G., вergamaschini L. et al. Pityriasis rubra pilaris and retinol-binding protein. вr J Dermatol 1981; №104 (3): 253-256.
• Vanderhooft S.L., Francis J. Familial pityriasis rubra pilaris. Arch Dermatol 1995; №131 (4): 448-453.
• Thomson M.A., Moss с. Pityriasis rubra pilaris in a mother and two daughters. вr J Dermatol 2007; №157 (1): 202-204.
• Sehgal V.N., Srivastava G., Dogra S. Adult onset pityriasis rubra pilaris. Indian J Dermatol Venereol Leprol 2008; №74 (4): 311-321.
• Klein A., Landthaler M., Karrer S. Pytiriasis rubra pilaris. A review of diagnosis and treatment. Am J сlin Dermatol 2010; №11 (3): 157-170.
• Griffiths W.A. Pityriasis rubra pilaris. сlin Exp Dermatol 1980; №5 (1): 105-112.
• Griffiths W.A., Ozluer S. Pityriasis rubra pilaire. Ann Dermatol Venereol 2001; №128 (8-9): 931-934.
• Gonz?lez-L?pez A., Velasco E., Pozo T. et al. HIV-associated pityriasis rubra pilaris responsive to triple antiretroviral therapy. вr J Dermatol 1999; №140 (5): 931-934.
• Auffret N., Quint L., Domart P. et al. Pityriasis rubra pilaris in a patient with human immunodeficiency virus infection. J Am Acad Dermatol 1992; №27 (2Pt1): 260-261.
• Resnick S.D., Murrell D.F., Woosley J.T. Pityriasis rubra pilaris, acne conglobata, and elongated follicular spines: an HIV-associated syndrome. J Am Acad Dermatol 1993; №29 (2Pt1): 283.
• Selvaag E., Haedersdal M., Thomsen K. Pityriasis rubra pilaris: a retrospective study of 12 patients. J Eur Acad Dermatol Venereol 2000; №14 (6): 514-515.
• Бутарева М.М., Знаменская Л.Ф., Безяева Ю.С., Каппушева И.А. Питириаз красный волосяной отрубевидный, сочетанный с синдромом Лезера-Трела. Вестник дерматологии и венерологии. 2013; №5: с.64-71.
• Олисова О.Ю., Теплюк Н.П., Плиева Р.Л., Ломоносов М. Эритродермическая форма болезни Девержи. Российский журнал кожных и венерических болезней. 2014; №1: с.18-20.
• Gregoriou S., Argyriou G., сhristofidou E. et al. Treatment of pityriasis rubra pilaris with pimecrolimus cream 1%. J Drugs Dermatol 2007; №6 (3): 340-342.
• van de Kerkhof P.C., Steijlen Topical treatment of pityriasis rubra pilaris with calcipotriol. вr J Dermatol 1994; №130 (5): 675-678.
• Allison D.S., el-Azhary R., сalobrisi S.D. et al. Pityriasis rubra pilaris in children. J Am Acad Dermatol 2002; №47 (3): 386-389.
• Goldsmith L.A., Weinrich A.E., Shupack J. Pityriasis rubra pilaris response to 13-cis-retinoic acid (isotretinoin). J Am Acad Dermatol 1982; №6 (4Pt2 Suppl): 710-715.
• Dicken с.H. Treatment of classic pityriasis rubra pilaris. J Am Acad Dermatol 1994; №31 (6): 997-999.
• вorok M., Lowe N.J. Pityriasis rubra pilaris: further observations of systemic retinoid therapy. J Am Acad Dermatol 1990; №22 (5Pt1): 792-795.
• сlayton в.D., Jorizzo J.L., Hichcock M.G. et al. Adult pityriasis rubra pilaris: a 10-year case series. J Am Acad Dermatol 1997; №36 (6Pt1): 959-964.
• Herbst R.A., Vogelbruch A.E., Kiehl P. et al. сombined ultraviolet A1 radiation and acitretin therapy as a treatment option for pityriasis rubra pilaris. вr J Dermatol 2000; №142 (3): 574-575.
• Neess с.M., Hinrichs R., Dissemond J. et al. Treatment of pruritus by capsaicin in a patient with pityriasis rubra pilaris receiving RE-PUVA therapy. сlin Exp Dermatol 2000; №25 (3): 209-211.
• Rosenbach A., Lowe N.J. Pityriasis rubra pilaris and cyclosporine. Arch Dermatol 1993; №129 (10): 1346-1348.
• Usuki K., Sekiyama M., Shimada T. et al. Three cases of pityriasis rubra pilaris successfully treated with cyclosporin A. Dermatology 2000; №200 (4): 324-327.
• Hunter G.A., Forbes I.J. Treatment of pityriasis rubra pilaris with azathioprine. вr J Dermatol 1972; №87 (1): 42-45.
• Kirby в, Watson R. Pityriasis rubra pilaris treated with acitretin and narrowband ultraviolet в (Re-TL-01). вr J Dermatol 2000; №142 (2): 376.
• van Dooren-Greebe R.J, van de Kerkhof P.C. Extensive extraspinal hyperostosis after long-term oral retinoid treatment in a patient with pityriasis rubra pilaris. J Am Acad Dermatol 1995; №32 (2Pt2): 322-325.
• Wetzig T, Sticherling M. Juvenile pityriasis rubra pilaris: successful treatment with ciclosporin. вr J Dermatol 2003; №149 (1): 202-203.
• Manoharan S., White S., Gumparthy K. Successful treatment of type I adult onset pityriasis rubra pilaris with infliximab. Australas J Dermatol 2006; №47 (2): 124-129.
• Drosou A., Kirsner R.S., Welsh E. et al. Use of infliximab, an anti-tumor necrosis alpha antibody, for inflammatory dermatoses. J сutan Med Surg 2003; №7 (5): 382-386.
• Ruiz-Genao D.P., Lopez-Estebaranz J.L., Naz-Villalba E. et al. Pityriasis rubra pilaris successfully treated with infliximab. Acta Derm Venereol 2007; №87 (6): 552-553.
• Ruzzetti M., Saraceno R., сarboni I. et al. Type III juvenile pityriasis rubra pilaris: a successful treatment with infliximab. J Eur Acad Dermatol Venereol 2008; №22 (1): 117-118.
• вarth D., Harth W., Treudler R., Simon J.C. Successful treatment of pityriasis rubra pilaris (type 1) under combination of infliximab and methotrexate. J Dtsch Dermatol Ges 2009; №7 (12): 1071-1073.
• Liao W.C., Mutasim D.F. Infliximab for the treatment of adult-onset pityriasis rubra pilaris. Arch Dermatol 2005; №141 (4): 423-425.
• Seckin D., Tula E., Ergun T. Successful use of etanercept in type I pityriasis rubra pilaris. вr J Dermatol 2007; №158 (3): 642-643.
• Guedes R., Leite L. Therapeutic hotline. Treatment of pityriasis rubra pilaris with etanercept. Dermatol Ther 2011; №24 (2): 285-286.
• Garcovich S., Di Giampetruzzi A.R., Antonelli G. et al. Treatment of refractory adult-onset pityriasis rubra pilaris with TNF-alpha antagonists: a case series. J Eur Acad Dermatol Venereol. 2010; №24 (8): 881-884.
• Walling H.W., Swick в.L. Pityriasis rubra pilaris responding rapidly to adalimumab. Arch Dermatol 2009; №145 (1): 99-101.
• Schreml S., Zeller V., вabilas P. et al. Pityriasis rubra pilaris successfully treated with adalimumab. сlin Exp Dermatol 2010; №35 (7): 792-793.
• Finzi A.F., Altomare G., вergamaschini L. et al. Pityriasis rubra pilaris and retinol-binding protein. вr J Dermatol 1981; №104 (3): 253-256.
• Vanderhooft S.L., Francis J. Familial pityriasis rubra pilaris. Arch Dermatol 1995; №131 (4): 448-453.
• Thomson M.A., Moss с. Pityriasis rubra pilaris in a mother and two daughters. вr J Dermatol 2007; №157 (1): 202-204.
• Sehgal V.N., Srivastava G., Dogra S. Adult onset pityriasis rubra pilaris. Indian J Dermatol Venereol Leprol 2008; №74 (4): 311-321.
• Klein A., Landthaler M., Karrer S. Pytiriasis rubra pilaris. A review of diagnosis and treatment. Am J сlin Dermatol 2010; №11 (3): 157-170.
• Griffiths W.A. Pityriasis rubra pilaris. сlin Exp Dermatol 1980; №5 (1): 105-112.
• Griffiths W.A., Ozluer S. Pityriasis rubra pilaire. Ann Dermatol Venereol 2001; №128 (8-9): 931-934.
• Gonz?lez-L?pez A., Velasco E., Pozo T. et al. HIV-associated pityriasis rubra pilaris responsive to triple antiretroviral therapy. вr J Dermatol 1999; №140 (5): 931-934.
• Auffret N., Quint L., Domart P. et al. Pityriasis rubra pilaris in a patient with human immunodeficiency virus infection. J Am Acad Dermatol 1992; №27 (2Pt1): 260-261.
• Resnick S.D., Murrell D.F., Woosley J.T. Pityriasis rubra pilaris, acne conglobata, and elongated follicular spines: an HIV-associated syndrome. J Am Acad Dermatol 1993; №29 (2Pt1): 283.
• Selvaag E., Haedersdal M., Thomsen K. Pityriasis rubra pilaris: a retrospective study of 12 patients. J Eur Acad Dermatol Venereol 2000; №14 (6): 514-515.
• Бутарева М.М., Знаменская Л.Ф., Безяева Ю.С., Каппушева И.А. Питириаз красный волосяной отрубевидный, сочетанный с синдромом Лезера-Трела. Вестник дерматологии и венерологии. 2013; №5: с.64-71.
• Олисова О.Ю., Теплюк Н.П., Плиева Р.Л., Ломоносов М. Эритродермическая форма болезни Девержи. Российский журнал кожных и венерических болезней. 2014; №1: с.18-20.
• Gregoriou S., Argyriou G., сhristofidou E. et al. Treatment of pityriasis rubra pilaris with pimecrolimus cream 1%. J Drugs Dermatol 2007; №6 (3): 340-342.
• van de Kerkhof P.C., Steijlen Topical treatment of pityriasis rubra pilaris with calcipotriol. вr J Dermatol 1994; №130 (5): 675-678.
• Allison D.S., el-Azhary R., сalobrisi S.D. et al. Pityriasis rubra pilaris in children. J Am Acad Dermatol 2002; №47 (3): 386-389.
• Goldsmith L.A., Weinrich A.E., Shupack J. Pityriasis rubra pilaris response to 13-cis-retinoic acid (isotretinoin). J Am Acad Dermatol 1982; №6 (4Pt2 Suppl): 710-715.
• Dicken с.H. Treatment of classic pityriasis rubra pilaris. J Am Acad Dermatol 1994; №31 (6): 997-999.
• вorok M., Lowe N.J. Pityriasis rubra pilaris: further observations of systemic retinoid therapy. J Am Acad Dermatol 1990; №22 (5Pt1): 792-795.
• сlayton в.D., Jorizzo J.L., Hichcock M.G. et al. Adult pityriasis rubra pilaris: a 10-year case series. J Am Acad Dermatol 1997; №36 (6Pt1): 959-964.
• Herbst R.A., Vogelbruch A.E., Kiehl P. et al. сombined ultraviolet A1 radiation and acitretin therapy as a treatment option for pityriasis rubra pilaris. вr J Dermatol 2000; №142 (3): 574-575.
• Neess с.M., Hinrichs R., Dissemond J. et al. Treatment of pruritus by capsaicin in a patient with pityriasis rubra pilaris receiving RE-PUVA therapy. сlin Exp Dermatol 2000; №25 (3): 209-211.
• Rosenbach A., Lowe N.J. Pityriasis rubra pilaris and cyclosporine. Arch Dermatol 1993; №129 (10): 1346-1348.
• Usuki K., Sekiyama M., Shimada T. et al. Three cases of pityriasis rubra pilaris successfully treated with cyclosporin A. Dermatology 2000; №200 (4): 324-327.
• Hunter G.A., Forbes I.J. Treatment of pityriasis rubra pilaris with azathioprine. вr J Dermatol 1972; №87 (1): 42-45.
• Kirby в, Watson R. Pityriasis rubra pilaris treated with acitretin and narrowband ultraviolet в (Re-TL-01). вr J Dermatol 2000; №142 (2): 376.
• van Dooren-Greebe R.J, van de Kerkhof P.C. Extensive extraspinal hyperostosis after long-term oral retinoid treatment in a patient with pityriasis rubra pilaris. J Am Acad Dermatol 1995; №32 (2Pt2): 322-325.
• Wetzig T, Sticherling M. Juvenile pityriasis rubra pilaris: successful treatment with ciclosporin. вr J Dermatol 2003; №149 (1): 202-203.
• Manoharan S., White S., Gumparthy K. Successful treatment of type I adult onset pityriasis rubra pilaris with infliximab. Australas J Dermatol 2006; №47 (2): 124-129.
• Drosou A., Kirsner R.S., Welsh E. et al. Use of infliximab, an anti-tumor necrosis alpha antibody, for inflammatory dermatoses. J сutan Med Surg 2003; №7 (5): 382-386.
• Ruiz-Genao D.P., Lopez-Estebaranz J.L., Naz-Villalba E. et al. Pityriasis rubra pilaris successfully treated with infliximab. Acta Derm Venereol 2007; №87 (6): 552-553.
• Ruzzetti M., Saraceno R., сarboni I. et al. Type III juvenile pityriasis rubra pilaris: a successful treatment with infliximab. J Eur Acad Dermatol Venereol 2008; №22 (1): 117-118.
• вarth D., Harth W., Treudler R., Simon J.C. Successful treatment of pityriasis rubra pilaris (type 1) under combination of infliximab and methotrexate. J Dtsch Dermatol Ges 2009; №7 (12): 1071-1073.
• Liao W.C., Mutasim D.F. Infliximab for the treatment of adult-onset pityriasis rubra pilaris. Arch Dermatol 2005; №141 (4): 423-425.
• Seckin D., Tula E., Ergun T. Successful use of etanercept in type I pityriasis rubra pilaris. вr J Dermatol 2007; №158 (3): 642-643.
• Guedes R., Leite L. Therapeutic hotline. Treatment of pityriasis rubra pilaris with etanercept. Dermatol Ther 2011; №24 (2): 285-286.
• Garcovich S., Di Giampetruzzi A.R., Antonelli G. et al. Treatment of refractory adult-onset pityriasis rubra pilaris with TNF-alpha antagonists: a case series. J Eur Acad Dermatol Venereol. 2010; №24 (8): 881-884.
• Walling H.W., Swick в.L. Pityriasis rubra pilaris responding rapidly to adalimumab. Arch Dermatol 2009; №145 (1): 99-101.
• Schreml S., Zeller V., вabilas P. et al. Pityriasis rubra pilaris successfully treated with adalimumab. сlin Exp Dermatol 2010; №35 (7): 792-793.
Appendices
Приложение А1.
Состав рабочей группы.• Кубанова Анна Алексеевна - академик РАН, доктор медицинских наук, профессор, Президент Российского общества дерматовенерологов и косметологов. Конфликт интересов отсутствует.
• Кубанов Алексей Алексеевич - член-корреспондент РАН, доктор медицинских наук, профессор, член Российского общества дерматовенерологов и косметологов. Конфликт интересов отсутствует.
• Карамова Арфеня Эдуардовна - кандидат медицинских наук, член Российского общества дерматовенерологов и косметологов. Конфликт интересов отсутствует.
• Знаменская Людмила Федоровна - доктор медицинских наук, член Российского общества дерматовенерологов и косметологов. Конфликт интересов отсутствует.
• Чикин Вадим Викторович - кандидат медицинских наук, член Российского общества дерматовенерологов и косметологов. Конфликт интересов отсутствует.
Приложение А2.
Методология разработки клинических рекомендаций.Целевая аудитория клинических рекомендаций:
• Врачи-дерматовенерологи;• Ординаторы и слушатели циклов повышения квалификации по специальности «Дерматовенерология».
Таблица П1- Уровни достоверности доказательств.
| Уровни достоверности доказательств | Описание |
| 1++ | Мета-анализы высокого качества, систематические обзоры рандомизированных контролируемых исследований (РКИ) или РКИ с очень низким риском систематических ошибок |
| 1+ | Качественно проведенные мета-анализы, систематические, или РКИ с низким риском систематических ошибок |
| 1- | Мета-анализы, систематические, или РКИ с высоким риском систематических ошибок |
| 2++ | Высококачественные систематические обзоры исследований случай-контроль или когортных исследований. Высококачественные обзоры исследований случай-контроль или когортных исследований с очень низким риском эффектов смешивания или систематических ошибок и средней вероятностью причинной взаимосвязи |
| 2+ | Хорошо проведенные исследования случай-контроль или когортные исследования со средним риском эффектов смешивания или систематических ошибок и средней вероятностью причинной взаимосвязи |
| 2- | Исследования случай-контроль или когортные исследования с высоким риском эффектов смешивания или систематических ошибок и средней вероятностью причинной взаимосвязи |
| 3 | Неаналитические исследования (например, описания случаев, серий случаев) |
| 4 | Мнение экспертов |
Таблица П2 - Уровни убедительности рекомендаций.
| Уровень убедительности доказательств | Характеристика показателя |
| А | По меньшей мере один мета-анализ, систематический обзор или РКИ, оцененные как 1++, напрямую применимые к целевой популяции и демонстрирующие устойчивость результатов или группа доказательств, включающая результаты исследований, оцененные как 1+, напрямую применимые к целевой популяции и демонстрирующие общую устойчивость результатов |
| В | Группа доказательств, включающая результаты исследований, оцененные как 2++, напрямую применимые к целевой популяции и демонстрирующие общую устойчивость результатов или экстраполированные доказательства из исследований, оцененных как 1++ или 1+ |
| С | Группа доказательств, включающая результаты исследований, оцененные как 2+, напрямую применимые к целевой популяции и демонстрирующие общую устойчивость результатов; или экстраполированные доказательства из исследований, оцененных как 2++ |
| D | Доказательства уровня 3 или 4; или экстраполированные доказательства из исследований, оцененных как 2+ |
Порядок обновления клинических рекомендаций.
Рекомендации в предварительной версии рецензируются независимыми экспертами. Комментарии, полученные от экспертов, систематизируются и обсуждаются членами рабочей группы. Вносимые в результате этого изменения в рекомендации или причины отказа от внесения изменений регистрируются.Предварительная версия рекомендаций выставляется для обсуждения на сайте ФГБУ «Государственный научный центр дерматовенерологии и косметологии» Минздрава России для того, чтобы лица, не участвующие в разработке рекомендаций, имели возможность принять участие в обсуждении и совершенствовании рекомендаций.
Для окончательной редакции и контроля качества рекомендации повторно анализируются членами рабочей группы.
Приложение А3.
Связанные документы.• Порядок оказания медицинской помощи по профилю «дерматовенерология», утвержденный Приказом Министерства здравоохранения Российской Федерации № 924н от 15 ноября 2012 г.
Приложение В.
Информация для пациентов.• Ацитретин и изотретиноин обладают тератогенным действием. В связи с этим при планирующейся терапии изотретиноином женщинам детородного возраста необходимо получить отрицательный результат достоверного теста на беременность в пределах 11 дней до начала приема препарата. Во время приема изотретиноина следует использовать противозачаточные средства, тест на беременность необходимо проводить ежемесячно во время лечения и через 5 недель после окончания лечения. При назначении ацитретина отрицательный тест на беременность должен быть получен за 2 недели до начала приема препарата. Во время лечения ацитретином рекомендуется проводить дополнительные обследования на беременность не реже 1 раза в месяц. Каждой женщине, способной к деторождению, абсолютно необходимо применять эффективные противозачаточные средства без перерывов в течение 4 недель до начала лечения, в процессе лечения и в течение двух лет после завершения лечения ацитретином;
• При планирующемся лечении методом фототерапии для исключения противопоказаний к нему необходимы консультации терапевта, эндокринолога, женщинам - гинеколога, при планировании ПУВА-терапии - офтальмолога с заключением о возможности проведения фототерапии;
• Во время лечения циклоспорином необходимо контролировать артериальное давление, регулярно проводить биохимический анализ крови для контроля концентрации концентрации креатинина плазмы, липидного профиля, содержания в крови калия, мочевой кислоты, билирубина, трансаминаз;
• Если назначается терапия азатиоприном, в период лечения женщины детородного возраста должны использовать надежные методы контрацепции. Необходимо регулярно проводить клинический анализ крови, включая определение тромбоцитов, а также биохимический анализ крови для контроля активности сывороточных печеночных трансаминаз, щелочной фосфатазы и уровня билирубина. При развитии любых инфекционных заболеваний, неожиданном появлении кровоподтеков, кровотечениях пациенту, которому проводится лечение циклоспорином, необходимо сообщить об этом врачу;
• Во время лечения метотрексатом необходимо контролировать состояние периферической крови, для чего следует регулярно проводить общий анализ крови с определением количества лейкоцитов и тромбоцитов. Необходимо контролировать активность печеночных трансаминаз, функцию почек, по необходимости проводить рентгенологическое исследование органов грудной клетки. При развитии диареи и язвенного стоматита, появлении признаков пульмональной токсичности (особенно сухой кашель без мокроты) лечение метотрексатом рекомендуется прекратить. Появление необычных кровотечений или кровоизлияний, черного дегтеобразного стула, крови в моче или кале или точечных красных пятен на коже требует немедленной консультации врача. Мужчинам и женщинам детородного возраста во время лечения метотрексатом и как минимум в течение 3 месяцев после следует применять надежные методы контрацепции;
При планировании биологической терапии препаратами инфликсимаб, этанерцепт, адалимумаб необходимо перед началом лечения провести общий и биохимический анализы крови, общий анализ мочи, рентгенографию органов грудной клетки, туберкулиновые пробы и консультацию фтизиатра с получением заключения о возможности проведения биологической терапии, обследование на ВИЧ-инфекцию и гепатиты В и С, женщинам детородного возраста - тест на беременность. Биологическая терапия не рекомендуется во время беременности. Поэтому при проведении биологической терапии и, по меньшей мере, 6 месяцев после ее окончания женщинам детородного возраста следует использовать надежные методы контрацепции. В процессе биологической терапии необходимо регулярно, согласно рекомендациям лечащего врача проводить клинический и биохимический анализ крови, общий анализ мочи, анализ крови на гепатит В, С и ВИЧ-инфекцию, тест на беременность, рентгенографию органов грудной клетки, ультразвуковое исследование органов брюшной полости, органов малого таза, предстательной железы (по показаниям), консультации фтизиатра, невролога, кардиолога.