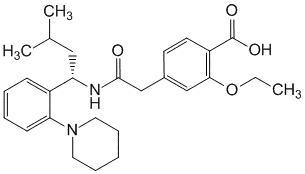
Active ingredients
Pharmacological Group
ATX code
L01FX05 Брентуксимаб ведотин.
Used in the treatment
Composition
| Лиофилизат для приготовления концентрата для приготовления раствора для инфузий | 1 фл. |
| действующее вещество: | |
| брентуксимаб ведотин (конъюгат, состоящий из СD30-направленного моноклонального антитела (сАС10), ковалентно связанного с монометилауристатином Е (ММАЕ) (SGD-1006) | 50 мг* |
| вспомогательные вещества: лимонной кислоты моногидрат - 2,1 мг; натрия цитрата дигидрат - 56,1 мг; α,α-трегалозы дигидрат - 700 мг; полисорбат 80 - 2 мг | |
| *Количество брентуксимаба ведотина, включая избыток 10%, составляет 55 мг. После восстановления каждый мл раствора содержит 5 мг брентуксимаба ведотина |
Pharmacological action
Фармакологическое действие -.
Противоопухолевое.
Противоопухолевое.
Method of drug use and dosage
В/в, в виде инфузий.
Препарат следует применять под наблюдением врача, имеющего опыт применения противоопухолевых препаратов.
Дозировка.
Ранее нелеченная лимфома Ходжкина.
Рекомендуемая доза в сочетании с химиотерапией AVD (доксорубицин [A], винбластин [V] и дакарбазин [D]) составляет 1,2 мг/кг, ее вводят в виде в/в инфузии в течение 30 мин в первый и пятнадцатый день каждого 28-дневного цикла из 6 циклов.
Первичная профилактика гранулоцитарным колониестимулирующим фактором (G-CSF) рекомендована всем пациентам, получающим комбинированную терапию первой линии, начиная с первой дозы.
Необходимо принимать во внимание информацию, приведенную в инструкциях по медицинскому применению химиотерапевтических средств, которые вводят в сочетании с брентуксимабом ведотином для первой линии терапии пациентов с лимфомой Ходжкина.
Лимфома Ходжкина при повышенном риске рецидива или прогрессирования заболевания.
Рекомендуемая доза составляет 1,8 мг/кг для введения в виде в/в инфузии в течение 30 мин каждые 3 нед.
Лечение брентуксимабом ведотином следует начать после восстановления от аутологичной трансплантации стволовых клеток на основании клинической оценки. Такие пациенты должны пройти до 16 курсов терапии.
Рецидивирующая/рефрактерная лимфома Ходжкина.
Рекомендуемая доза составляет 1,8 мг/кг в виде в/в инфузии в течение 30 мин каждые 3 нед.
Рекомендуемая начальная доза для повторного лечения пациентов с предыдущим ответом на терапию брентуксимабом ведотином составляет 1,8 мг/кг в виде в/в инфузии в течение 30 мин каждые 3 нед. Лечение также можно начать с последней переносимой дозы.
Лечение следует продолжать до прогрессирования заболевания или неприемлемой токсичности.
При достижении стабилизации заболевания или ответа на терапию в виде частичной или полной ремиссии пациент должен пройти как минимум 8, но не более 16 циклов лечения (приблизительно 1 год).
Рецидивирующая/рефрактерная системная анапластическая крупноклеточная лимфома (сАККЛ).
Лечение следует продолжать до прогрессирования заболевания или нежелательной неприемлемой токсичности.
Т-клеточная лимфома кожи (ТКЛК).
Пациенты с ТКЛК должны пройти до 16 курсов терапии.
Общие указания.
Если масса тела пациента превышает 100 кг, при расчете дозы следует использовать значение массы 100 кг.
Перед каждым введением дозы брентуксимаба ведотина должен проводиться клинический анализ крови. Пациенты должны находиться под наблюдением во время и после инфузии.
Расчет дозы.
Вычисление общего объема (мл) раствора препарата для дальнейшего разведения.
Доза препарата (мг/кг) × масса тела пациента (кг)/концентрация восстановленного во флаконе раствора (5 мг/мл) = общая доза препарата (мл) для дальнейшего разведения.
Вычисление требуемого количества флаконов препарата.
Общая доза препарата (мл) для введения/общий объем в одном флаконе (10 мл/флакон) = требуемое количество флаконов препарата.
Таблица 1.
Примеры вычислений для пациентов с массой тела от 60 до 120 кг. Использована рекомендуемая доза препарата 1,8 мг/кг.
аВ случае сниженной дозы в расчетах используют значение 1,2 мг/кг.
бДля разведения в 150 мл раствора и введения методом в/в инфузии в течение 30 мин каждые 3 нед.
вЕсли масса тела пациента превышает 100 кг, при расчете дозы следует использовать значение массы 100 кг.
гМаксимальная рекомендуемая доза составляет 180 мг.
Таблица 2.
Примеры вычислений для пациентов, получающих рекомендуемую дозу препарата 1,2 мг/кг, с массой тела от 60 до 120 кг, в комбинированной терапии или при необходимости уменьшения дозы.
аВ случае сниженной дозы в расчетах используют значение 0,9 мг/кг.
бДля разведения в 150 мл раствора и введения методом в/в инфузии в течение 30 мин каждые 3 нед.
вЕсли масса тела пациента превышает 100 кг, при расчете дозы следует использовать значение массы 100 кг.
гМаксимальная рекомендуемая доза составляет 120 мг.
Корректировка доз.
Нейтропения.
Если в процессе лечения обнаруживается нейтропения, для ее контроля следует увеличить интервалы между дозами. Соответствующие рекомендации по дозированию приведены в таблице 3.
Таблица 3.
Рекомендации по дозированию при нейтропении.
аКлассификация основана на «Общей терминологии критериев нежелательных реакций» (CTCAE) в. 3.0 Национального онкологического института (NCI).
бПри развитии лимфопении 3-й и 4-й степени тяжести пациенты могут продолжать лечение без изменений.
Периферическая нейропатия.
При возникновении или усугублении периферической сенсорной или моторной нейропатии в период лечения необходимо следовать следующим рекомендациям по дозированию (таблица 4).
Таблица 4.
Рекомендации по дозированию при впервые выявленной или прогрессирующей сенсорной или моторной нейропатии.
аКлассификация основана на сTCAE в. 3.0 NCI.
Особые группы пациентов.
Почечная и печеночная недостаточность.
Комбинированная терапия. Пациенты с почечной недостаточностью должны находиться под строгим наблюдением на предмет развития нежелательных явлений. Отсутствует опыт клинических исследований использования брентуксимаба ведотина в сочетании с химиотерапией у пациентов с почечной недостаточностью, когда сывороточный креатинин ≥2 мг/дл и/или сl креатинина или расчетный сl креатинина ≤40 мл/мин. Следует избегать применения брентуксимаба ведотина в сочетании с химиотерапией у пациентов с почечной недостаточностью тяжелой степени.
Пациенты с печеночной недостаточностью должны находиться под строгим наблюдением на предмет развития нежелательных явлений. У пациентов с печеночной недостаточностью легкой степени рекомендуемая стартовая доза составляет 0,9 мг/кг для введения в виде в/в инфузии в течение 30 мин каждые 3 нед. Отсутствует опыт клинических исследований использования брентуксимаба ведотина в сочетании с химиотерапией у пациентов с печеночной недостаточностью, когда общий билирубин более чем в 1,5 раза превышает верхний предел нормы (ВПН) (за исключением синдрома Жильбера) или активность АСТ или АЛТ более чем в 3 раза превышает ВПН, либо активность АСТ или АЛТ более чем в 5 раз превышает ВПН, если данное повышение может быть обосновано поражением печени лимфомой Ходжкина. Следует избегать применения брентуксимаба ведотина в сочетании с химиотерапией у пациентов с печеночной недостаточностью средней и тяжелой степени.
Монотерапия. Рекомендуемая стартовая доза для лечения пациентов с почечной недостаточностью тяжелой степени составляет 1,2 мг/кг в виде в/в инфузии в течение 30 мин каждые 3 нед. Пациенты с почечной недостаточностью должны находиться под строгим наблюдением на предмет развития нежелательных явлений.
Рекомендуемая стартовая доза для лечения пациентов с печеночной недостаточностью составляет 1,2 мг/кг в виде в/в инфузии в течение 30 мин каждые 3 нед. Пациенты с печеночной недостаточностью должны находиться под строгим наблюдением на предмет развития нежелательных явлений.
Пациенты пожилого возраста.
Рекомендации по дозированию для пациентов 65 лет и старше соответствуют таковым для взрослых пациентов.
Детская популяция.
Безопасность и эффективность применения препарата у детей младше 18 лет не были установлены. Рекомендаций по дозировке не может быть сделано.
Приготовление инфузионного раствора.
Общие меры предосторожности.
Во время использования препарата необходимо соблюдать асептические условия.
Инструкция по приготовлению восстановленного раствора.
1. Содержимое одного флакона для одноразового применения необходимо растворить в 10,5 мл стерильной воды для инъекций, чтобы получить раствор объемом 11 мл (включая растворенные твердые частицы) с конечной концентрацией брентуксимаба ведотина 5 мг/мл. Направить струю по стенке флакона. Не направлять струю непосредственно на лиофилизированную массу или порошок.
2. Осторожно повернуть флакон для облегчения растворения. Не встряхивать.
3. Восстановленный во флаконе раствор должен быть прозрачным или слегка опалесцирующим, бесцветным. Конечный показатель pH должен быть равен 6,6.
4. Восстановленный раствор необходимо осмотреть на предмет отсутствия посторонних механических включений и/или изменения окраски. В случае обнаружения посторонних механических включений и/или изменения окраски раствор необходимо уничтожить.
Инструкция по приготовлению раствора для введения.
Необходимое количество восстановленного раствора препарата следует извлечь из флакона(ов) и добавить в содержащий раствор натрия хлорида для инъекций 9 мг/мл (0,9%) инфузионный пакет, рекомендуемый объем которого 150 мл, чтобы получить конечную концентрацию препарата, равную 0,4-1,2 мг/мл. Восстановленный раствор также может быть разбавлен с помощью 5% раствора глюкозы для инъекций или раствора Рингера лактата для инъекций.
Аккуратно перевернуть пакет для перемешивания раствора препарата. Не встряхивать.
Не допускается добавление других лекарственных препаратов к приготовленному инфузионному раствору или в/в инфузионной системе. Инфузионную систему необходимо промыть раствором натрия хлорида для инъекций 9 мг/мл (0,9%) или с помощью 5% раствора глюкозы для инъекций или раствора Рингера лактата для инъекций.
Инфузию препарата проводят немедленно после приготовления раствора.
Общее время хранения раствора от момента растворения до получения инфузии пациентом не должно превышать 24 ч при температуре от 2 до 8 °C, препарат не содержит консервантов.
Способ применения.
Рекомендуемую дозу препарата вводят в виде инфузии в течение 30 мин.
Инструкции по растворению и разведению перед введением препарата приведены в подразделе Приготовление инфузионного раствора.
Не допускается введение раствора препарата с помощью в/в струйного или болюсного введения. Раствор препарата следует вводить через отдельный в/в катетер, при этом его нельзя смешивать с другими лекарственными препаратами.
Препарат следует применять под наблюдением врача, имеющего опыт применения противоопухолевых препаратов.
Дозировка.
Ранее нелеченная лимфома Ходжкина.
Рекомендуемая доза в сочетании с химиотерапией AVD (доксорубицин [A], винбластин [V] и дакарбазин [D]) составляет 1,2 мг/кг, ее вводят в виде в/в инфузии в течение 30 мин в первый и пятнадцатый день каждого 28-дневного цикла из 6 циклов.
Первичная профилактика гранулоцитарным колониестимулирующим фактором (G-CSF) рекомендована всем пациентам, получающим комбинированную терапию первой линии, начиная с первой дозы.
Необходимо принимать во внимание информацию, приведенную в инструкциях по медицинскому применению химиотерапевтических средств, которые вводят в сочетании с брентуксимабом ведотином для первой линии терапии пациентов с лимфомой Ходжкина.
Лимфома Ходжкина при повышенном риске рецидива или прогрессирования заболевания.
Рекомендуемая доза составляет 1,8 мг/кг для введения в виде в/в инфузии в течение 30 мин каждые 3 нед.
Лечение брентуксимабом ведотином следует начать после восстановления от аутологичной трансплантации стволовых клеток на основании клинической оценки. Такие пациенты должны пройти до 16 курсов терапии.
Рецидивирующая/рефрактерная лимфома Ходжкина.
Рекомендуемая доза составляет 1,8 мг/кг в виде в/в инфузии в течение 30 мин каждые 3 нед.
Рекомендуемая начальная доза для повторного лечения пациентов с предыдущим ответом на терапию брентуксимабом ведотином составляет 1,8 мг/кг в виде в/в инфузии в течение 30 мин каждые 3 нед. Лечение также можно начать с последней переносимой дозы.
Лечение следует продолжать до прогрессирования заболевания или неприемлемой токсичности.
При достижении стабилизации заболевания или ответа на терапию в виде частичной или полной ремиссии пациент должен пройти как минимум 8, но не более 16 циклов лечения (приблизительно 1 год).
Рецидивирующая/рефрактерная системная анапластическая крупноклеточная лимфома (сАККЛ).
Лечение следует продолжать до прогрессирования заболевания или нежелательной неприемлемой токсичности.
Т-клеточная лимфома кожи (ТКЛК).
Пациенты с ТКЛК должны пройти до 16 курсов терапии.
Общие указания.
Если масса тела пациента превышает 100 кг, при расчете дозы следует использовать значение массы 100 кг.
Перед каждым введением дозы брентуксимаба ведотина должен проводиться клинический анализ крови. Пациенты должны находиться под наблюдением во время и после инфузии.
Расчет дозы.
Вычисление общего объема (мл) раствора препарата для дальнейшего разведения.
Доза препарата (мг/кг) × масса тела пациента (кг)/концентрация восстановленного во флаконе раствора (5 мг/мл) = общая доза препарата (мл) для дальнейшего разведения.
Вычисление требуемого количества флаконов препарата.
Общая доза препарата (мл) для введения/общий объем в одном флаконе (10 мл/флакон) = требуемое количество флаконов препарата.
Таблица 1.
Примеры вычислений для пациентов с массой тела от 60 до 120 кг. Использована рекомендуемая доза препарата 1,8 мг/кг.
| Масса тела пациента, кг | Общая доза = масса тела пациента, умноженная на рекомендуемую дозу (1,8 мг/кга), мг | Общий объем для разведенияб = общая доза, разделенная на концентрацию раствора, восстановленного во флаконе (5 мг/мл), мл | Требуемое количество флаконов = общий объем для разведения, разделенный на общий объем в одном флаконе (10 мл/флакон), фл. |
| 60 | 108 | 21,6 | 2,16 |
| 80 | 144 | 28,8 | 2,88 |
| 100 | 180 | 36 | 3,6 |
| 120в | 180г | 36 | 3,6 |
аВ случае сниженной дозы в расчетах используют значение 1,2 мг/кг.
бДля разведения в 150 мл раствора и введения методом в/в инфузии в течение 30 мин каждые 3 нед.
вЕсли масса тела пациента превышает 100 кг, при расчете дозы следует использовать значение массы 100 кг.
гМаксимальная рекомендуемая доза составляет 180 мг.
Таблица 2.
Примеры вычислений для пациентов, получающих рекомендуемую дозу препарата 1,2 мг/кг, с массой тела от 60 до 120 кг, в комбинированной терапии или при необходимости уменьшения дозы.
| Общая доза = масса тела пациента, умноженная на рекомендуемую дозу (1,2 мг/кга), мг | |||
| 60 | 72 | 14,4 | 1,44 |
| 80 | 96 | 19,2 | 1,92 |
| 100 | 120 | 24 | 2,4 |
| 120г | 24 | 2,4 |
аВ случае сниженной дозы в расчетах используют значение 0,9 мг/кг.
бДля разведения в 150 мл раствора и введения методом в/в инфузии в течение 30 мин каждые 3 нед.
вЕсли масса тела пациента превышает 100 кг, при расчете дозы следует использовать значение массы 100 кг.
гМаксимальная рекомендуемая доза составляет 120 мг.
Корректировка доз.
Нейтропения.
Если в процессе лечения обнаруживается нейтропения, для ее контроля следует увеличить интервалы между дозами. Соответствующие рекомендации по дозированию приведены в таблице 3.
Таблица 3.
Рекомендации по дозированию при нейтропении.
| Степень тяжести нейтропении (признаки и симптомы [сокращенное описание сTCAEa]) | Монотерапия | Комбинированная терапия Примечание. Первичная профилактика G-CSF рекомендована всем пациентам, получающим комбинированную терапию, начиная с первой дозы |
| Изменение режима дозирования | ||
| Степень 1 (<НГН-1500/мм3, <НГН-1,5·109/л) или степень 2 (<1500-1000/мм3, <1,5-1·109/л) | Продолжить лечение по прежней схеме и в той же самой дозировке | |
| Степень 3 (<1000-500/мм3, <1-0,5·109/л) или степень 4 (<500/мм3, <0,5·109/л) | Остановить лечение до возвращения степени тяжести нейтропении к ≤степени 2 или исходному уровню, затем продолжить лечение по прежней схеме и в той же самой дозировкеб. При развитии нейтропении 3-й или 4-й степени тяжести возможно дополнительное назначение рекомбинантных гемопоэтических факторов (G-CSF или гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) | При развитии нейтропении 3-й или 4-й степени тяжести возможно дополнительное назначение гемопоэтических факторов роста (G-CSF, GM-CSF) |
аКлассификация основана на «Общей терминологии критериев нежелательных реакций» (CTCAE) в. 3.0 Национального онкологического института (NCI).
бПри развитии лимфопении 3-й и 4-й степени тяжести пациенты могут продолжать лечение без изменений.
Периферическая нейропатия.
При возникновении или усугублении периферической сенсорной или моторной нейропатии в период лечения необходимо следовать следующим рекомендациям по дозированию (таблица 4).
Таблица 4.
Рекомендации по дозированию при впервые выявленной или прогрессирующей сенсорной или моторной нейропатии.
| Степень тяжести прогрессирующей сенсорной или моторной нейропатии (признаки и симптомы [сокращенное описание СТСАЕа]) | ||
| Степень 1 (парестезия и/или выпадение рефлексов, без потери функциональности) | ||
| Степень 2 (нарушение функциональности, но без очевидного влияния на повседневную активность) | Остановить лечение до возвращения степени тяжести нейропатии к ≤степени 1 или исходному уровню, затем повторно начать лечение, используя сниженную дозировку 1,2 мг/кг до максимум 120 мг каждые 3 нед | Снизить дозировку до 0,9 мг/кг до максимум 90 мг каждые 2 нед |
| Степень 3 (затруднение повседневной активности) | Приостановить лечение до возвращения степени тяжести нейропатии к ≤степени 1 или исходному уровню, затем возобновить лечение с использованием сниженной дозировки 1,2 мг/кг каждые 3 нед | Приостановить лечение до возвращения степени тяжести нейропатии к ≤степени 2, затем возобновить лечение с использованием сниженной дозировки 0,9 мг/кг каждые 2 нед |
| Степень 4 (сенсорная нейропатия, приводящая к недееспособности, или моторная нейропатия, опасная для жизни или приводящая к параличу) | Прекратить лечение |
аКлассификация основана на сTCAE в. 3.0 NCI.
Особые группы пациентов.
Почечная и печеночная недостаточность.
Комбинированная терапия. Пациенты с почечной недостаточностью должны находиться под строгим наблюдением на предмет развития нежелательных явлений. Отсутствует опыт клинических исследований использования брентуксимаба ведотина в сочетании с химиотерапией у пациентов с почечной недостаточностью, когда сывороточный креатинин ≥2 мг/дл и/или сl креатинина или расчетный сl креатинина ≤40 мл/мин. Следует избегать применения брентуксимаба ведотина в сочетании с химиотерапией у пациентов с почечной недостаточностью тяжелой степени.
Пациенты с печеночной недостаточностью должны находиться под строгим наблюдением на предмет развития нежелательных явлений. У пациентов с печеночной недостаточностью легкой степени рекомендуемая стартовая доза составляет 0,9 мг/кг для введения в виде в/в инфузии в течение 30 мин каждые 3 нед. Отсутствует опыт клинических исследований использования брентуксимаба ведотина в сочетании с химиотерапией у пациентов с печеночной недостаточностью, когда общий билирубин более чем в 1,5 раза превышает верхний предел нормы (ВПН) (за исключением синдрома Жильбера) или активность АСТ или АЛТ более чем в 3 раза превышает ВПН, либо активность АСТ или АЛТ более чем в 5 раз превышает ВПН, если данное повышение может быть обосновано поражением печени лимфомой Ходжкина. Следует избегать применения брентуксимаба ведотина в сочетании с химиотерапией у пациентов с печеночной недостаточностью средней и тяжелой степени.
Монотерапия. Рекомендуемая стартовая доза для лечения пациентов с почечной недостаточностью тяжелой степени составляет 1,2 мг/кг в виде в/в инфузии в течение 30 мин каждые 3 нед. Пациенты с почечной недостаточностью должны находиться под строгим наблюдением на предмет развития нежелательных явлений.
Рекомендуемая стартовая доза для лечения пациентов с печеночной недостаточностью составляет 1,2 мг/кг в виде в/в инфузии в течение 30 мин каждые 3 нед. Пациенты с печеночной недостаточностью должны находиться под строгим наблюдением на предмет развития нежелательных явлений.
Пациенты пожилого возраста.
Рекомендации по дозированию для пациентов 65 лет и старше соответствуют таковым для взрослых пациентов.
Детская популяция.
Безопасность и эффективность применения препарата у детей младше 18 лет не были установлены. Рекомендаций по дозировке не может быть сделано.
Приготовление инфузионного раствора.
Общие меры предосторожности.
Во время использования препарата необходимо соблюдать асептические условия.
Инструкция по приготовлению восстановленного раствора.
1. Содержимое одного флакона для одноразового применения необходимо растворить в 10,5 мл стерильной воды для инъекций, чтобы получить раствор объемом 11 мл (включая растворенные твердые частицы) с конечной концентрацией брентуксимаба ведотина 5 мг/мл. Направить струю по стенке флакона. Не направлять струю непосредственно на лиофилизированную массу или порошок.
2. Осторожно повернуть флакон для облегчения растворения. Не встряхивать.
3. Восстановленный во флаконе раствор должен быть прозрачным или слегка опалесцирующим, бесцветным. Конечный показатель pH должен быть равен 6,6.
4. Восстановленный раствор необходимо осмотреть на предмет отсутствия посторонних механических включений и/или изменения окраски. В случае обнаружения посторонних механических включений и/или изменения окраски раствор необходимо уничтожить.
Инструкция по приготовлению раствора для введения.
Необходимое количество восстановленного раствора препарата следует извлечь из флакона(ов) и добавить в содержащий раствор натрия хлорида для инъекций 9 мг/мл (0,9%) инфузионный пакет, рекомендуемый объем которого 150 мл, чтобы получить конечную концентрацию препарата, равную 0,4-1,2 мг/мл. Восстановленный раствор также может быть разбавлен с помощью 5% раствора глюкозы для инъекций или раствора Рингера лактата для инъекций.
Аккуратно перевернуть пакет для перемешивания раствора препарата. Не встряхивать.
Не допускается добавление других лекарственных препаратов к приготовленному инфузионному раствору или в/в инфузионной системе. Инфузионную систему необходимо промыть раствором натрия хлорида для инъекций 9 мг/мл (0,9%) или с помощью 5% раствора глюкозы для инъекций или раствора Рингера лактата для инъекций.
Инфузию препарата проводят немедленно после приготовления раствора.
Общее время хранения раствора от момента растворения до получения инфузии пациентом не должно превышать 24 ч при температуре от 2 до 8 °C, препарат не содержит консервантов.
Способ применения.
Рекомендуемую дозу препарата вводят в виде инфузии в течение 30 мин.
Инструкции по растворению и разведению перед введением препарата приведены в подразделе Приготовление инфузионного раствора.
Не допускается введение раствора препарата с помощью в/в струйного или болюсного введения. Раствор препарата следует вводить через отдельный в/в катетер, при этом его нельзя смешивать с другими лекарственными препаратами.
Description of the dosage form
Лиофилизат для приготовления концентрата для приготовления раствора для инфузий, 50 мг. По 50 мг брентуксимаба ведотина во флаконе из прозрачного стекла I типа, укупоренном резиновой пробкой, обжатой колпачком алюминиевым с крышкой из полипропилена. 1 фл. в картонной подставке помещают в картонную пачку. На пачку наклеивают защитные наклейки для контроля первого вскрытия упаковки.
В случае упаковки на ОАО «Фармстандарт-УфаВИТА», Россия: по 50 мг брентуксимаба ведотина во флаконе из прозрачного стекла I типа, укупоренном резиновой пробкой, обжатой колпачком алюминиевым с крышкой из полипропилена. 1 фл. помещают в картонную пачку. На пачку наклеивают защитные наклейки для контроля первого вскрытия упаковки.
В случае упаковки на ОАО «Фармстандарт-УфаВИТА», Россия: по 50 мг брентуксимаба ведотина во флаконе из прозрачного стекла I типа, укупоренном резиновой пробкой, обжатой колпачком алюминиевым с крышкой из полипропилена. 1 фл. помещают в картонную пачку. На пачку наклеивают защитные наклейки для контроля первого вскрытия упаковки.
Conditions of vacation from pharmacies
По рецепту.
Storage conditions
При температуре 2-8 °C в потребительской упаковке для защиты от света.
Восстановленный/инфузионный раствор хранить при температуре 2-8 °C не более 24 Не замораживать.
Хранить в недоступном для детей месте.
Восстановленный/инфузионный раствор хранить при температуре 2-8 °C не более 24 Не замораживать.
Хранить в недоступном для детей месте.
Expiration date
4 года.
Не применять по истечении срока годности, указанного на упаковке.
Не применять по истечении срока годности, указанного на упаковке.